Carbonate de magnésium
Le carbonate de magnésium (MgCO3) est un solide de couleur blanche, qui se trouve à l'état minéral dans la nature. Sous forme de poudre, le carbonate de magnésium est utilisé comme anti-transpirant dans de nombreux sports, connu sous le nom de magnésie.
Pour les articles homonymes, voir Magnésie.
| Carbonate de magnésium | |
  |
|
| Carbonate de magnésium en poudre. | |
| Identification | |
|---|---|
| Nom UICPA | carbonate de magnésium |
| Synonymes |
magnésite |
| No CAS | |
| No ECHA | 100.008.106 |
| No CE | 208-915-9 |
| Code ATC | A02 A06 |
| PubChem | 11029 |
| ChEBI | 31793 |
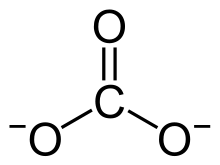
| SMILES | |
| InChI | |
| Apparence | poudre blanche |
| Propriétés chimiques | |
| Formule | MgCO3 |
| Masse molaire[1] | 84,3139 ± 0,0023 g/mol C 14,25 %, Mg 28,83 %, O 56,93 %, |
| Propriétés physiques | |
| T° fusion | 350 °C (décomposition)[2] |
| Solubilité | 0,106 g l−1 (eau, 20 °C)[2] |
| Masse volumique | 2,96 g cm−3 (à 20 °C)[2] |
| Thermochimie | |
| S0solide | 65,84 J K−1 mol−1[3] |
| ΔfH0solide | −1 111,69 kJ mol−1[3] |
| Précautions | |
| NFPA 704[4] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés physico-chimiques
Pour des températures supérieures à 400 °C, une décarboxylation du carbonate de magnésium a lieu et forme l'oxyde de magnésium :
Utilisation
Sous forme de poudre appelée couramment « magnésie » — même si en chimie, la magnésie désigne de fait l'oxyde de magnésium —, le carbonate de magnésium est utilisé dans certains sports comme la gymnastique artistique, l'escalade ou l'haltérophilie pour assécher les mains[5]. La formule de cette poudre est plus précisément (MgCO3)4Mg(OH)25H2O. Elle peut contenir une faible proportion de silice qui, inhalée, peut avoir des effets sur les poumons.[réf. nécessaire]

Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Magnesium(II) carbonat » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 4 mai 2010 (JavaScript nécessaire)
- (en) « Magnesium carbonate », sur NIST/WebBook (consulté le 4 mai 2010)
- UCB, université du Colorado
- « Colophane et magnésie », sur cosiroc.fr, (consulté le ).
- Portail de la chimie
- Portail de la gymnastique
- Portail de l’alpinisme et de l’escalade
- Portail de la pharmacie
