BODIPY
BODIPY, abréviation de bore-dipyrrométhene, est une famille de colorants qui absorbent fortement dans l'UV-visible et qui ont la propriété d'émettre une fluorescence étroite avec un rendement quantique important[1]. Ils dérivent tous du 4,4-difluoro-4-bora-3a, 4a-diaza-s-indacène.
Les BODIPY sont peu sensibles à la polarité et au pH de leur environnement et sont stables dans les conditions physiologiques. Un intérêt de ces colorants provient du fait que leur fluorescence change avec de faibles modifications structurales. Il est donc possible de concevoir un BODIPY répondant à une exigence de fluorescence imposée par une utilisation donnée.
Généralités
Histoire
Les BODIPY ont été préparés pour la première fois en 1968 par Treibs et Kreuzer[2]. Le BODIPY non-substitué n'a été préparé qu'en 2009[3]. La difficulté de cette synthèse est probablement due à la grande sensibilité à l'attaque électrophile qu'il pourrait subir. Le Bodipy non substitué présente une fluorescence de 7,2 ns et a une grande photostabilité.
Une grande variété de BODIPY a été préparée. Peu sont solubles dans l'eau.
Nomenclature
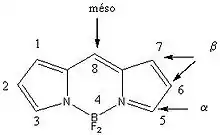
La nomenclature des BODIPY est basée sur la numération fixée par l'IUPAC[4]. L'utilisation des termes alpha, bêta et méso est largement répandue.
Bodipy de référence
Le 3,5-diméthylBODIPY peut servir de référence afin de comparer les autres membres de la famille. La longueur d'onde d'absorption maximale est 507 nm et la longueur d'onde maximale d'émission est 520 nm; le rendement quantique de fluorescence est 0,81 dans l'éthanol.
BODIPY substitués
Effet de la substitution en méso
La substitution en méso a peu d'influence sur les longueurs d'onde d'émission et d'absorption du BODIPY[4]. Par exemple, le 3,5-diméthyl-8-phénylBODIPY possède une longueur d'onde d'absorption maximale de 508 nm (au lieu de 507 nm) et la longueur d'onde maximale d'émission est 521 nm (au lieu de 520 nm). Le rendement quantique, en revanche, est largement affecté, il vaut 0,19 (au lieu de 0,81) dans l'éthanol pour l'exemple ci-dessous.

L'importante différence entre les deux rendements de fluorescence pour les BODIPYs substitués ou pas en 1 et 7 est attribué au fait que la substitution empêche la libre rotation du groupement phényle. L'absence de libre rotation diminue en effet la possibilité de donner des transitions non radiatives à la suite de mouvements moléculaires. Cela se traduit par le fait que la présence de substituant en 1 et 7 augmente le rendement quantique[4].
Synthèse des BODIPY
Les BODIPY les plus simples se préparent en deux étapes. Par exemple
- Réaction de deux pyrroles avec un chlorure d'acide (ou d'un anhydride d'acide) puis oxydation du pont méso (DDQ, p-chloranil)
- Réaction du composé bicyclique de l'étape précédente avec BF3 éthérate.
ou
- Réaction de deux pyrroles avec un aldéhyde puis oxydation du pont méso (DDQ, p-chloranil)
- Réaction avec BF3 éthérate.
ou
- Réaction de deux pyrroles dont un porteur d'un aldéhyde catalysée par POCl3 pour obtenir le dipyrromethène libre en méso
- Réaction avec BF3 éthérate.
il est aussi possible de transformer un BODIPY pour obtenir un autre BODIPY, par exemple par réaction de substitution électrophile aromatique (sulfonation, nitration, etc.)[4]. Ils sont stables dans la plupart des conditions réactionnelles classiques.
Notes et références
- Karolin J., Johansson L. B. A., Strandberg L. & Ny T. (1994). J. Am. Chem. Soc. 116, 7801–7806.
- Treibs, A.; Kreuzer, F. H. Justus Liebigs Ann. Chem. 1968, 718, 208.
- (en) A. Schmitt, B. Hinkeldey, M. Wild, G. Jung, « Synthesis of the Core Compound of the BODIPY Dye Class: 4,4′-Difluoro-4-bora-(3a,4a)-diaza-s-indacene », J. Fluoresc., vol. 19, , p. 755–759 (DOI 10.1007/s10895-008-0446-7)
- Loudet A. & Burgess K. (2007). BODIPY Dyes and Their Derivatives: Syntheses and Spectroscopic Properties. Chem. Rev. 107, 4891-4932.
- Portail de la chimie