Ascophyllum nodosum
Goémon noir, Ascophylle noueuse (Amér. Nord)

Ascophyllum nodosum, aussi dite Goémon noir, algue noueuse, robert[2], favach (en breton) et dont le nom est parfois francisé au Québec en Ascophylle noueuse[3], est une espèce d'algues de la classe des Phaeophyceae.
C'est la seule représentante, actuellement reconnue, du genre Ascophyllum[4], dans la famille des Fucaceae.
Cette algue brune en forme de « corde à nœuds » peut atteindre plus de 1,50 m de longueur. Elle est commune le long des côtes rocheuses de l'Atlantique nord, où elle forme des colonies denses dans la zone de balancement des marées.
C'est une des principales espèces d'algues collectées par les goémoniers comme source d'engrais agricole. Elle est aussi récoltée pour l'extraction d'alginates ou la préparation de composants alimentaires. Elle est, comme d'autres fucacées, en voie de régression, pour des raisons encore mal comprises.
Synonymes ou anciennes dénominations

.jpg.webp)
Le specimen représenté ne possède pas la forme typique.
Ces noms sont maintenant désuets, mais cette espèce a autrefois pu être nommée :
- Fucus nodosus Linnaeus 1753
- Ascophyllum laevigatum Stackhouse 1809
- Fistularia nodosa Stackhouse 1816
- Halicoccus nodosus Lyngbye 1819
- Ozothallia nodosa Decaisne et Thuret 1845
- Fucodium nodosum J. Agardh 1848
- Ascophyllum nodosum var. scorpioides (Hauck) Reinke 1889
- Ascophylla nodosa Kuntze 1894
Description morphologique
Bien que faisant partie des algues brunes, Ascophyllum nodosum présente une couleur générale plutôt vert-olive, vert-jaunâtre ou brun-jaunâtre. Cependant lorsque les thalles se déshydratent, l'oxydation des pigments polyphénoliques provoque le noircissement de l'algue[R 1], qui est ainsi connue comme le « goémon noir »[7].
L'algue est fixée au substrat par un crampon étroit. Le thalle, qui peut mesurer jusqu'à 150 cm de longueur et jusqu'à 3 m dans les provinces maritimes atlantiques du Canada[8], est constitué de longues lanières lisses, ramifiées, étroites et aplaties, qui présentent à intervalles assez réguliers des renflements, qui ont valu à cette algue le qualificatif de « noueuse ». Ces « nœuds », situés dans l'épaisseur du thalle, sont des aérocystes emplis de gaz qui jouent le rôle de flotteurs. Latéralement apparaissent de courtes ramifications fines qui évoluent en réceptacles portant les conceptacles où se prépare la reproduction sexuée.
Ascophyllum nodosum peut cependant présenter d'importantes variations de forme. Certaines sont manifestement liées à la variabilité génétique de l'espèce. D'autres sont induites par les conditions d'habitat[B 1]: il existe en particulier des populations flottantes représentées par la forme mackayi (que l'on trouve par exemple dans les fonds abrités des lochs écossais[9]) et par la forme scorpioides (que l'on trouve surtout dans les marais salés nord-américains en association avec Spartina alterniflora). Ces formes présentent de nombreuses ramifications latérales, minces et cylindriques et une raréfaction des flotteurs et des réceptacles. Elles diffèrent tant d'aspect de la population d'origine dont elles se sont détachées qu'elles ont pu être autrefois considérées comme des espèces voire des genres distincts[10].
Nomenclature
Dans le système binominal qu'il mettait en place et qui allait devenir le système scientifique universel de nomenclature, Carl von Linné attribua à l'espèce en 1753 le nom de Fucus nodosus[11], qui signifie en latin « plante marine » pour Fucus et « noueuse » pour nodosus.
Cependant celle-ci se distingue par des fructifications latérales (et non terminales) et des oogones à quatre oosphères (et non huit), ce qui valut à John Stackhouse d'en faire, en 1809, le type d'un nouveau genre biologique, différent de Fucus, et de renommer l'algue Ascophylla laevigata[12]. Le nom Ascophylla est formé à partir des racines grecques ἀσκός (askos) qui désigne une sorte de vase ou une outre, l'outre faisant référence aux flotteurs, et φύλλον (phyllon), la feuille. L'épithète laevigata peut se traduire en latin « très glissante ». Ce sont donc les « très glissantes feuilles à petites outres ».
Enfin, en 1864, Auguste-François Le Jolis, tout en reconnaissant la pertinence de la distinction faite par Stackhouse, rétablit le nom selon les règles de la nomenclature, celle du genre grammatical et celle de l'antériorité. L'espèce devient alors, et ce jusqu'à nos jours, Ascophyllum nodosum[13].
Biologie
Ascophyllum nodosum est une algue pérenne qui peut vivre de nombreuses années : les thalles pourraient atteindre une longévité de 25 ans[R 2] et les touffes, qui sont capables de se régénérer par leur base, plusieurs siècles[14]. La croissance est lente : à partir de la troisième année, la lanière ne s'allonge chaque année que de la longueur qui sépare deux flotteurs (en général 8 à 15 cm) et il ne se forme sur un "rameau" qu'un seul flotteur par an[15]. En comptant ces derniers, on peut estimer l'âge de l'algue (1 flotteur par an à partir de la 3e année) qui peut atteindre 15 ans[16].
Ascophyllum nodosum se reproduit végétativement et sexuellement. La reproduction végétative s'accomplit par la production de nouvelles pousses au niveau du crampon et constitue le principal mode de maintien et de renouvellement des populations[15].

Chez Ascophyllum nodosum, les sexes sont séparés : les touffes sont soit mâles, soit femelles[17]. Les réceptacles apparaissent en décembre sur les bords de la fronde et prennent une teinte jaune d'or. Ils sont fertiles de février à avril et se détachent après fructification[18]. Lorsque les algues libèrent leurs gamètes, les spermatozoïdes sont attirés par les oosphères par l'effet d'une phéromone, le « finnavarène », du nom de la localité de Finnavara dans le comté de Clare, en République d'Irlande[19]

Comme chez toutes les Fucales, le thalle est diploïde. La phase haploïde est quant à elle très réduite : elle se résume après la méiose à une seule mitose pour la formation des gamètes femelles et à une succession de quatre mitoses pour la formation des gamètes mâles. Longtemps considérés comme des gamétophytes produisant directement des gamètes dans le cadre d'un cycle monogénétique[15], les thalles des Fucales, auxquelles appartient Ascophyllum nodosum, doivent être plutôt interprétés comme des « sporophytes ayant un gamétophyte inclus »[R 3], de manière analogue au cas des plantes à fleurs.
En milieu naturel, Ascophyllum nodosum réalise une association symbiotique, de type mycophycobiose, avec un champignon ascomycète de l'espèce Mycophycias ascophylli qui est hébergé à l'intérieur de l'algue dans les espaces extra-cellulaires. On constate que cette association est générale pour tous les thalles de plus d'un an ; le champignon qui profite des polysaccharides et de la biotine de l'algue, pourrait aider celle-ci dans les mécanismes de transfert de minéraux et dans la résistance à la dessication lorsque la marée est basse[20].
L'algue est également l'hôte exclusif d'une petite algue rouge semi-parasite, Vertebrata lanosa[R 4] qui forme de petits pompons externes. Ascophyllum nodosum héberge également dans le mucilage de ses réceptacles une diatomée endophyte, Navicula endophytica[21]
Répartition et habitat
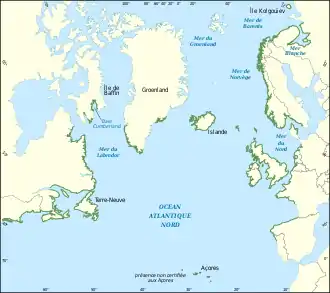
Ascophyllum nodosum est présente sur le littoral de l'océan Atlantique nord. On trouve cette espèce :
- en Europe, de la mer Blanche et de la Norvège jusqu'au Portugal[14],
- en Amérique du Nord (y compris le Groenland), du cercle Arctique jusqu'au 40e parallèle nord[22],[14].
Au-delà de cette zone, des échouages dans les laisses de mer sont signalés au nord au Svalbard[23] et au sud aux Açores[24], mais l'espèce n'y semble pas implantée.
Les algues vivent accrochées aux rochers de l'eulittoral et plus précisément de la zone de mi-marée (étage médiolittoral [R 5]) jusqu'à environ 15 m de profondeur). Elle peut densément recouvrir les roches, notamment dans des zones assez calmes, mais elle forme souvent des communautés avec d'autres espèces, dont (en France[25]) :
- Fucus vesiculosus (fucus vésiculeux)
- Corallina spp.
- Phymatolithon lenormandii
- Cladophora rupestris
- Gelidium pusillum
- Mastocarpus stellatus
Des espèces opportunistes peuvent s'y associer, dont par exemple[25] : ectocarpales, Sporulations vertes, ulves (Ulva sp.) dont Ulva compressa, Ceramium ciliatum...
Utilisation
Ascophyllum nodosum est récoltée comme engrais, comme ressource alimentaire pour le bétail ou comme matière première pour l'extraction d'alginates[26]. C'est en importance de la biomasse, la principale espèce représentative du « goémon de rive » (ou « goémon d'attache ») qui est coupé à pied à marée basse ou avec des machines spécialisées. La récolte est dans la plupart des pays et de longue date réglementée. En Bretagne, l'arrêté préfectoral relatif à l'exploitation durable des goémons de rives interdit l'arrachage de Ascophyllum nodosum et impose une coupe à hauteur minimale de 30 cm[27].
Traditionnellement, l'engraissage des champs se fait par simple épandage d'algues préalablement séchées et éventuellement mélangées à du fumier. La coupe est organisée au printemps (avril-mai) et l'épandage est réalisé en automne après les récoltes agricoles[28]. L'intérêt comme engrais est lié à la haute teneur en macro-éléments, (tels que les éléments N, P, K, Ca, Mg, S) et oligo-éléments (par exemple Mn, Cu, Fe, Zn, etc.) On trouve aussi des phytohormones telles que bétaïne, cytokinine, auxine et gibbérelline (stimulateurs de croissance), du mannitol, des acides organiques, polysaccharides, acides aminés, et protéines, toutes bénéfiques à l'agriculture [29].
L'utilisation comme aliment du bétail est manifestement ancienne. Les noms utilisés en Norvège, où l'espèce est abondante, en attestent : grisetang (de grise, le porc et de tang, pour les algues de type Fucus ) ou hesttang (de hest, le cheval)[B 2]. La consommation humaine directe est rare, elle est signalée chez certains Inuits du Groenland, comme complément diététique[B 3].
Cependant, c'est l'utilisation comme source d'alginates qui est aujourd'hui prédominante. Les récoltes auraient ainsi été de plus de 80 000 tonnes en masse humide pour l'Europe dans les années 1995-1996 [30] et de 5 000 à 6 000 tonnes pour le Canada en moyenne au cours des années 1970-1980[31].
État des populations, pressions et menaces
C'est une des algues « d'intérêt économique » récoltées par les goémoniers et elle fait à ce titre l'objet d'un suivi particulier pour s'assurer de la pérennité de la ressource.
Cependant elle semble en légère régression presque partout en Europe. Localement elle est même en forte régression, notamment en Bretagne-Sud où des mesures sont effectuées depuis les années 1990 et où le phénomène est étudié par l'Ifremer et le CEVA[32].
Elle est souvent exposée aux hydrocarbures, elle y résiste plutôt bien, mais ils peuvent affecter son métabolisme (inhibition de croissance) et induire des nécroses après 3 jours d'exposition expérimentale en bassin de plein air[33]. Les capacités de reproduction de la colonie ne semblent cependant pas affectées[33]
En Bretagne, comme en Irlande du Nord , le broutage intensif par les patelles est incontestablement en cause [34],[35],[36],[37],[38],[39],[40]. Ces mollusques grignotent et fragilisent les thalles jusqu'à disparition, mais les raisons de leur prolifération et de leur agressivité sont encore mal comprises[41]. En Bretagne nord, la disparition de certaines ceintures algales a été très rapide ; par exemple : disparition totale entre 2006 et 2009 au niveau de l’île Dame Jouanne et de la pointe rocheuse située à l’Est de la baie de Saint-Briac, et à l'ouest de l'estuaire de la Rance (Côtes-d'Armor[25]), dans des zones par ailleurs concernées par les marées vertes indicatrices de graves déséquilibres écologiques.
La régression de ces algues peut avoir des effets collatéraux sur les espèces qu'elle abrite, ou sur les espèces qui se nourrissent de ses cadavres (« nécromasse ») apportés par la mer sur les rivages sous forme de laisse de mer, Orchestia gammarellus et Talitrus saltator, par exemple, maillons d'une chaine alimentaire qui concerne les poissons et les oiseaux.
Galerie



Notes et références
- Références principales
- Bruno de Reviers, Biologie et phylogénie des algues, t. 1, Paris, Belin, coll. « Belin Sup Sciences », , 352 p. (ISBN 978-2-7011-3083-5, ISSN 1158-3762, notice BnF no FRBNF39004485)
- page 117
- page 284
- pages 251-255
- page 186
- page 188
- T. Belsher, Étude bibliographique de quelques espèces planctoniques et benthiques littorales de la Manche, vol. 4 : Phytobenthos, Brest, IFREMER, , 53 p. (lire en ligne), « Ascophyllum nodosum », p. 163-218
- § 4.1.
- § 10.1.
- § 10.1.1.
- Autres références
- (en) Référence Index Nominum Algarum : espèce synonyme Fucus nodosus
- Données d'observation pour la reconnaissance et l'identification de la faune et de la flore subaquatiques (DORIS) : Ascophyllum nodosum (Linnaeus) Le Jolis
- Office québécois de la langue française : rockweed / ascophylle noueuse
- (en) Référence AlgaeBase : genre Ascophyllum Stackhouse
- (en) William Grosart Johnstone et Alexander Groall (ill. Henry Bradbury), The nature-printed British sea-weeds : a history, accompanied by figures and dissections, of the algae of the Bristish isles, vol. III : Melanospermae, Londres, Bradbury and Evans, , 200 p. (lire en ligne), « Plate CXXXIX, Fucus nodosus », p. 22
- (en) William Henry Harvey, Phycologia Britannica : a history of British sea-weeds, vol. 1 : Melanospermae, or olive sea-weeds, Londres, Reeve and Benham, 1846-51 (lire en ligne), « Planche 158, Fucus nodosus »
- Mer et littoral, J.-C. Julien : description de Ascophyllum nodosum, décembre 2007.
- Michael Lohmann, Flore et faune du littoral, Chantecler, (ISBN 978-2-8034-2778-9), p. 30
- (en) Michael Scott, Managing seashores for Sea Loch Egg Wrack, Ascophyllum nodosum ecad mackayi, Salisbury, Wiltshire, Plantlife International – The Wild Plant Conservation Charity, , 12 p. (lire en ligne)
- Ascophyllum mackayi (Turner) Holmes & Batters 1892 ((en) Référence AlgaeBase : espèce Ascophyllum mackayi (Turner) Holmes & Batters) et Chordaria scorpioides (Hornemann) Lyngbye 1819 ((en) Référence AlgaeBase : espèce Chordaria scorpioides (Hornemann) Lyngbye)
- (la) Carolus Linnaeus, Species Plantarum : exhibentes plantas rite cognitas ad genera relatas cum differentiis specificis, nominibus trivialibus, synonymis selectis, locis natalibus, vol. 2, Stockholm, Laurent Salvius, (lire en ligne), « Cryptogamia algae », p. 1159
- (la) John Stackhouse, « Tentamen marino-cryptogamicum, ordinem novum in genera et species distributum, in Classe XXIVta Linnaei sistens », Mémoires de la Société Imperiale des Naturalistes de Moscou, , p. 50-97
- Auguste-François Le Jolis, Liste des algues marines de Cherbourg, t. X, Paris & Cherbourg, J.B. Baillière et fils & Bedelfontaine et Syffert, coll. « Mémoires de la société impériale dess ciences naturelles de Cherbourg », (lire en ligne), p. 96
- (en) Référence AlgaeBase : espèce Ascophyllum nodosum (Linnaeus) Le Jolis
- (en) Lorna Kelly, Louise Collier, Mark J. Costello, Michael Diver, Seamus McGarvey, Stefan Kraan, Jim Morrissey et Michael D. Guiry, Impact assessment of hand and mechanical harvesting of Ascophyllum nodosum on regeneration and biodiversity, Abbotstown, Dublin 15, Marine fisheries services division, Marine Institute, coll. « Marine resource series / 19 », , 57 p. (lire en ligne)
- Jean-Paul Alayse, Yann Le Nozer'h, Les algues, éditions Jean-Paul Gisserot, , p. 21
- (en) Climate change impacts and adaptation program natural resources Canada, Project A515, Climate change and thermal sensitivity of Canadian Atlantic commercial marine species : « Fucus serratus, serrated wrack, Fucus vesiculosus, bladder wrack or rockweed, and Ascophyllum nodosum, knotted wrack or rockweed (Order Fucales) »
- « Ascophyllum nodosum (Linnaeus) Le Jolis », Université Pierre-et-Marie-Curie, station biologique de Roscoff, inventaire des algues de Roscoff.
- (en) Michael Guiry’s seaweed site : « Ascophyllum nodosum (L.) Le Jolis »
- Marc-André Selosse et François Le Tacon, « Les stratégies symbiotiques de conquête du milieu terrestre par les végétaux », Année biologique, Éditions scientifiques et médicales Elsevier SAS, no 40, , p. 3-20 (lire en ligne)
-
(en) Grethe R. Hasle, « Navicula endophytica Sp.Nov. : a pennate diatom with an unusual mode of existence », European Journal of Phycology, vol. 3, no 3, , p. 475 — 480 (DOI 10.1080/00071616800650071, lire en ligne)Institute for Marine Biology, B, University of Oslo, Norway
- (en) Organisation des Nations unies pour l'alimentation et l'agriculture (FAO), « Ascophyllum nodosum and its harvesting in Eastern Canada ».
- (en) Geir Johnsen, Egil Sakshaug et Kit Kovacs, Ecosystem Barents Sea, Trondheim, Tapir Academic Press, , 587 p. (ISBN 978-82-519-2461-0, présentation en ligne), chap. 15 (« Benthic life »), p. 368
- (pt) Universidade dos Açores, Departamento de Oceanografia e Pescas, « Algas, espécie não registada para os Açores, Feófitas » : Ascophyllum nodosum
- Université de Bretagne Occidentale, Institut Universitaire Européen de la Mer, « Contrôle de surveillance DCE 2009 Suivi de la flore benthique Masses d’eau côtières : - FRFC03- Rance – Fresnaye, - FRGC11- Baie de Morlaix, - FRGC16- Rade de Brest, - FRGC36- Baie de Quiberon ». Cf. page 3 relative aux macroalgues intertidales de la masse d’eau FRGC03.
- FRCIVAM Bretagne, « Usage traditionnel et proto-industriel des algues en Bretagne », octobre 2006.
- Direction régionale des affaires maritimes de Bretagne : Arrêté préfectoral du 17 avril 2009 relatif à l'exploitation durable des goémons de rives sur le littoral de la Bretagne
- FRCIVAM Bretagne, « Savoir-faire anciens et exploitation des algues en Bretagne », octobre 2006.
- (en) J. Norrie et D. A. Hiltz, « Seaweed Extract Research and Applications in Agriculture », Agro food Industry hi-tech,
- (en) FAO Seaweeds Used as a Source of Alginate : 4.6 Quantities harvested
- (en) FAO :Ascophyllum nodosum and its harvesting in Eastern Canada.
- Poster du réseau REBENT sur la régression des Fucales en France
- (en) Kjersti Sjotun, Tor Eiliv Lein, « Experimental oil exposure of Ascophyllum nodosum », Journal of Experimental Marine Biology and Ecology, août 1993, 170 (2), p.197-212 (ISSN 0022-0981)
- Auguste Le Roux, « Les patelles et la régression des algues brunes dans le Morbihan », Penn Ar Bed n°192, mars 2005, p. 1-22.
- F. et F. Madic, « La régression des algues brunes en Finistère Sud. Exemple de la crique de Portec et de ses environs », Penn Ar Bed n°192, mars 2005, p.23-34.
- A. Le Roux, « Les Patelles (Patella vulgata L.), agents de la destruction de la couverture algale des estrans rocheux du Golfe du Morbihan », Bulletin de la Société de sciences naturelles de l'Ouest de la France n°30, janvier 2008, p.162-180.
- (en) S. Lorenzen, « The limpet Patella vulgata L. at night in air : effective feeding on Ascopgyllum nodosum monocultures and stranded seaweeds », Journal of Molluscan studies n°73, 2007, p. 267-274.
- (en) A. J. Davies, M.P. Johnson et C.A. Maggs, « Limpet grazing and loss of Ascophyllum nodosum canopies on decadal time Scales », Marine Ecology Progress Series n°339, 2007, p.131-141.
- A. Le Roux, « Quoi de neuf chez les patelles, Patella vulgata L? », Penn ar Bed n°212, janvier 2012, p.29-40.
- A. Le Roux, « Famine chez les berniques ? », 2007 (lire en ligne).
- A. Le Roux, « Littoral : les ceintures de fucacées menacées ? », Telabotanica.
Liens externes
- (en) Référence BioLib : Ascophyllum nodosum (Linnaeus) Le Jolis
- (fr) Référence DORIS : espèce Ascophyllum nodosum
- (fr) Référence INPN : Ascophyllum nodosum (L.) Le Jolis, 1863
- (fr) Référence SeaLifeBase : (consulté le )
- (en) Référence AlgaeBase : espèce Ascophyllum nodosum (Linnaeus) Le Jolis (consulté le )
- (fr+en) Référence ITIS : Ascophyllum nodosum Scorpiodes (consulté le )
- (en) Référence World Register of Marine Species : espèce Ascophyllum nodosum (Linnaeus) Le Jolis, 1863 (consulté le )
- (en) Référence NCBI : Ascophyllum nodosum (taxons inclus) (consulté le )
- (en) Référence uBio : Ascophyllum nodosum Scorpiodes (consulté le )
- Portail de la biologie marine
- Portail de la phycologie