Équation chimique
Une équation chimique est un écrit symbolique qui modélise la transformation de molécules et d'atomes lors d'une réaction chimique. Elle peut se présenter sous plusieurs formes :
- réactifs
→produits (réaction chimique irréversible ; la forme la plus courante dans les livres de chimie); la transformation n'est possible que dans un seul sens. - réactifs
→produits + énergie (réaction chimique irréversible) - réactifs
⇌produits + énergie (réaction réversible); la transformation directe est limitée par la transformation inverse, simultanée.
Par exemple, la combustion du méthane dans le dioxygène est décrite par :
- CH4 + 2 O2 → CO2 + 2 H2O,
alors que la réaction réversible du procédé Haber se décrit par:
- N2 + 3 H2
⇌2 NH3 + 92,4 kJ
Les équations chimiques sont appelées parfois équations de réaction ou équations-bilans à ne pas confondre avec les bilans de réactions.
Exemple de bilan de réaction: Méthane + dioxygène → dioxyde de carbone + eau
Description
Chaque molécule est représentée par sa formule chimique : brute, semi-développée ou développée plane (voir aussi l'article sur la représentation des molécules). Les atomes d'une molécule sont écrits groupés, le nombre d'atomes au sein de la molécule est indiqué après le symbole chimique, en indice, par exemple : la molécule d'eau H2O est composée de deux atomes d'hydrogène et d'un atome d'oxygène. Pour un cristal monoatomique, on note simplement l'atome, par exemple Fe pour un cristal de fer. Si un cristal est composé de plusieurs espèces chimiques, on indique une maille (ou une sous-maille) comme une molécule, par exemple Al2O3 pour un cristal d'alumine.
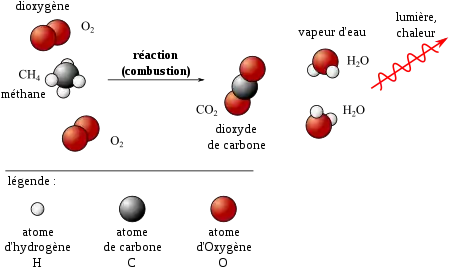
La réaction chimique est représentée par une flèche allant vers la droite, certains préconisent son remplacement par le signe égal mais celui-ci, qui est une relation d'équivalence, ne rend pas compte de la notion d'écoulement du temps c'est-à-dire de la distinction entre réactifs et produits. Les réactifs sont indiqués à gauche de la flèche, les produits de réaction à droite. S'il faut plusieurs molécules de même nature pour la réaction, on indique ce nombre (entier) avant la molécule ; ce nombre est appelé « coefficient stœchiométrique ». Par exemple, l'équation chimique de la combustion complète du méthane dans le dioxygène est
- CH4 + 2O2
→CO2 + 2H2O
Le bilan du nombre d'atomes à gauche et à droite doit être équilibré (ci-dessus : de chaque côté de la flèche, on a un atome C, quatre atomes H et quatre atomes O).
Les coefficients stœchiométriques sont donc des entiers. Cependant, pour simplifier l'écriture dans certains cas, on divise tous les coefficients par un même entier, on a donc des coefficients fractionnaires, mais il s'agit d'un artifice de notation.
Si la réaction peut se faire dans les deux sens (équilibre), on note deux flèches superposées, une allant vers la droite, l'autre vers la gauche : « ⇄ » ou « ⇌ ». Lorsque ce caractère n'est pas disponible, on utilise un signe égal « = » ; la double flèche « ↔ » doit être toujours évitée car elle correspond à un équilibre mésomère. Par exemple, la dissociation de l'eau peut être notée par
- 2H2O
⇄H3O+ + HO− - ou
- 2H2O = H3O+ + HO−
- ou
- 2H2O
⇌H3O+ + HO−
Les signes « + » et « - » en exposant indiquent la charge portée par les ions.
Dans le cas de réactions en phase solide, on utilise la notation de Kröger et Vink.
Notion de demi-équation
Certaines transformations chimiques peuvent s'interpréter par un transfert d'électrons entre les réactifs. Le transfert s'effectue d'une espèce chimique réductrice (notée généralement Red) sur une espèce chimique oxydante (notée Ox). L'espèce qui cède des électrons (Red) est oxydée; l'espèce qui capte ces électrons (Ox) est réduite. Ces transformations sont des réactions d'oxydo-réduction.
Prenons deux exemples :
- Zn + Cu2+ → Zn2+ + Cu
- Interprétation :
- Zn → Zn2+ + 2e− ; Zn (le réducteur) cède des électrons, il est oxydé
- Cu2+ + 2e− → Cu ; Cu2+ (l'oxydant) capte les électrons cédés par Zn, il est réduit ;
- Cu + 2Ag+ → Cu2+ + 2Ag ;
la transformation de l'élément cuivre s'effectue ici dans le sens inverse de celui vu précédemment : Cu → Cu2+ + 2e−
Conclusion : selon la réaction, la transformation peut s'effectuer du métal à l'ion ou de l'ion au métal.
L'ion et le métal, issus du même élément cuivre, constituent un couple oxydant-réducteur (anciennement « couple redox »). Nous avons ici utilisé trois couples oxydant-réducteur, que l'on note respectivement :
- Cu2+/Cu ;
- Zn2+/Zn ;
- Ag+/Ag.
Pour chacun de ces couples, on définit une demi-équation électronique, faisant intervenir les électrons comme si c'était une espèce chimique :
- pour le couple Cu2+/Cu, la demi-équation électronique est :
Cu2+ + 2 e− = Cu ; - pour Zn2+/Zn :
Zn2+ + 2 e− = Zn ; - pour Ag+/Ag :
Ag+ + e− = Ag.
De manière générale, le comportement de tout couple Ox/Red est symbolisé par la demi-équation électronique :
- Ox + ne− = Red
(le sens est déterminé par chaque cas particulier).
Une réaction d'oxydo-réduction fait intervenir deux couples Ox/Red ; l'équation de la réaction est la combinaison des deux demi-équations correspondantes.
Influence
La découverte de la notion de stœchiométrie, c'est-à-dire le fait que les produits chimiques réagissent en proportions entières, par John Dalton en 1804, fut l'un des arguments décisifs en faveur de la théorie atomique de la matière.