Introduction
Afin d'illustrer ce que signifient différentes lois de vitesse, ce chapitre propose un rapide tour d'horizon des réactions simples d'ordre zéro, un ou deux — les plus courantes. Cela nous servira également à déterminer, expérimentalement, la cinétique d'une réaction.
Une réaction fait habituellement intervenir plusieurs réactifs. Ces réactifs peuvent chacun influencer la loi de vitesse, si bien qu’il est impossible de déterminer la loi de vitesse s'ils changent tous de concentration simultanément. Pour rendre la chose possible, on fixe la concentration de tous les réactifs, sauf un. On peut alors déterminer l’ordre partiel correspondant à ce réactif précis. La même méthode appliquée aux autres nous fournit alors chaque ordre partiel, lorsque cela est possible.
Cas très simple : un seul réactif
- ordre 1
Le cas le plus simple, auquel nous essaierons de nous ramener tant que possible, est celui d'un réactif unique, X, qui réagit « spontanément » (c'est-à-dire sans que quoi que ce soit le pousse à le faire) pour donner un ou plusieurs produits. On suppose de plus que les produits éventuellement formés n'influencent en rien le comportement de X. Ces réactions sont du type:
En radioactivité, on a par exemple: 238U → 234Th + 4He (désintégration α)
- ordre 2
Ces réactions sont du type:
La loi de vitesse s'écrit :
- avec r = 1 ou 2
Cas plus réaliste : plusieurs réactifs
Lorsqu’il y a plusieurs réactifs, on utilise l'astuce suivante : mettre en très large excès les réactifs qui ne nous intéressent pas. Ainsi, leur concentration varie relativement peu. Voici concrètement à quoi cela ressemble :
La loi de vitesse est a priori :
Mettons B et C en large excès, alors :
Si bien que la loi de vitesse s'écrit :
Ce que l’on peut encore noter :
avec
On dit qu’il y a dégénérescence de l'ordre de la réaction : elle était d'ordre global a+b+c, elle n'est maintenant plus que d'ordre a. Le paramètre kapp est appelé constante apparente de réaction, elle dépend des concentrations initiales en B et C.
Nous nous sommes ainsi ramenés à une loi de vitesse analogue à celle que l’on aurait pour un unique réactif : on peut étudier la réaction avec les mêmes outils.
Réaction d'ordre 0
Définition
Une réaction d'ordre global zéro se caractérise par une loi de vitesse de la forme :
Il s'agit souvent de réactions n'impliquant qu'un seul réactif, X.
L'unité de k est ici celle de v : dans le système SI mol.m⁻³.s⁻¹, pour les chimistes mol.L⁻¹.s⁻¹.
Remarque : la vitesse d'une telle réaction ne dépend absolument pas de la composition du système — elle est constante. De telles réactions sont très rares dans la nature. On peut se demander comment on peut avoir un ordre 0. En fait, les réactions d'ordre zéro sont souvent des réactions complexes où par exemple, la vitesse est déterminée par une étape limitante où la concentration de A n'intervient pas. On peut aussi trouver un ordre 0 quand un processus physique intervient. Certaines combustions suivent un ordre 0 , ce qui permet de définir une vitesse de flamme.
Exemple et propriétés

Un exemple de réaction d'ordre zéro : la combustion d'une bougie dans l'air. La « cire » de la bougie, mélange de stéarine et de paraffine, brûle à une vitesse pratiquement constante, jusqu'à disparition complète de la cire. La réaction est en réalité très complexe, mais sa cinétique apparaît plutôt simple.
On a, d’après la définition de la vitesse de réaction :
Puisque la réaction est d'ordre zéro, on a d’autre part :
Ainsi, la loi de vitesse s'écrit :
Ce qui s'intègre facilement entre t = 0 et l'instant présent :
La concentration du réactif en fonction du temps vaut :
avec [X]₀ la concentration initiale en composé X.
| Cette loi n'est valable que tant que la réaction se poursuit ! On n'aura bien sûr pas de « concentrations négatives ». |
La réaction s'achève une fois tout le réactif consommé, ce qui correspond à un temps
- .
Réaction d'ordre 1
Définition
Une réaction d'ordre un obéit à une loi de la forme suivante :
Ce sont généralement des réactions qui n'impliquent qu'un réactif.
Exemples et propriétés
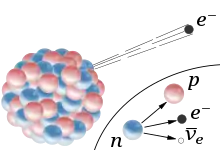
Les exemples de réactions d'ordre un sont courants : c’est l'un des cas les plus courants. Une telle loi caractérise souvent un phénomène « spontané », comme par exemple les phénomènes de décroissance radioactive : le taux de décroissance est proportionnel au nombre de noyaux. On écrit :
Étudions l'évolution de la concentration de X dans le temps. La loi de vitesse s'écrit :
ce qu'on peut encore écrire :
Cette loi s'intègre facilement entre l'instant initial et l'instant actuel :

La concentration du composé X suit la loi suivante :
Ce qu'on écrit encore :
Remarque : on introduit parfois (lire « tau égale un sur k »), appelée constante de temps. Plus cette durée est petite, plus le phénomène est rapide.
Autre remarque : une telle réaction n'est jamais complète, puisque les concentrations n'atteignent pas zéro.
Puisque les réactions d'ordre un ne se terminent pas, il n'y a pas de sens à calculer un « temps de réaction ». Au lieu de cela, on s'intéresse au temps de demi-réaction, au bout duquel la moitié du réactif a été consommée :
Déterminons la valeur de :
Le temps de demi-réaction pour une réaction d'ordre un est égal à :
Remarques expérimentales
- Une réaction d'ordre un est d'autant plus rapide que le réactif est concentré. Pour assurer une production efficace, on a donc tout intérêt à maintenir la concentration constante, en ajoutant le réactif à la solution, ou en éliminant le produit lorsque cela est possible.
Réaction d'ordre 2
Définition
On appelle réaction d'ordre deux une réaction qui suit une loi de vitesse de la forme :
Exemples et propriétés

Des réactions suivant cette loi ne sont pas rares, elles correspondent généralement à une collision entre deux réactifs identiques, ou entre deux réactifs ayant même coefficients stœchiométriques et même concentration au départ. Un exemple simple est la réaction de saponification d'un ester, comme l'éthanoate d'éthyle.
Étudions l'évolution temporelle de la concentration :
Ce qui s'intègre facilement entre l'instant initial et l'instant final :
La concentration en réactif obéit à la loi suivante :
| Attention au signe « + » ! |
Le temps de demi-réaction pour une réaction d'ordre deux vaut :
Remarque : contrairement à une réaction d'ordre un, le temps de demi-réaction dépend ici de la concentration initiale !