Introduction
- Après la lecture de cette leçon, vous pourrez tester votre compréhension sur l’exercice 1.
Jusqu'ici, nous avons essentiellement abordé la cinétique chimique d'un point de vue expérimental. Les lois de vitesse, les ordres partiels ou globaux, demeurent des données de l'expérience.
Parfois, il est possible de justifier la cinétique d'une réaction comme le résultat d'un mécanisme microscopique. C'est ce que nous présentons dans ce chapitre.
Mécanisme cinétique
Il importe de distinguer différents mécanismes et, au sein de ceux-ci, différentes étapes particulières.
Étapes élémentaires
Une étape élémentaire (ou réaction élémentaire) correspond à une collision entre un, deux, ou très rarement trois espèces (atomes, molécules, électrons, etc) qui aboutit à la formation d'un ou plusieurs produits.
Une telle réaction peut se faire entre des atomes, des molécules , des ions ... Parfois des espèces très réactives sont susceptibles d'intervenir comme :
- des radicaux (par exemple HO·) ;
- des atomes excités (par exemple H*) ;
- des ions exotiques (par exemple C+) ;
- des électrons
- etc ...
Mécanismes chimiques
- Mécanisme chimique et cinétique
Les réactions élémentaires s'enchaînent, jusqu'à ce que les espèces ne réagissent plus aussi rapidement.
On appelle mécanisme chimique une chaîne d'étapes élémentaires qui aboutit à des produits relativement stables. Une équation bilan récapitule uniquement les réactifs consommés et les produits formés, sans tenir compte des espèces intermédiaires.
En quelque sorte, une équation bilan « masque » les réactions chimiques, alors que le mécanisme les détaille. En thermodynamique, on peut généralement étudier les propriétés d'une transformation en connaissant uniquement l'état de départ et l'état d'arrivée, en revanche, en cinétique, le chemin joue un rôle décisif.
On note
- une étape élémentaire avec une flèche →
- un bilan de réaction avec le signe =
- un équilibre chimique avec le signe
Chaque mécanisme possède une certaine structure. Au sein d'un mécanisme, on retrouve :
- Une ou deux étapes d’activation ou d’initiation : elles forment les intermédiaires réactifs et nécessitent généralement un apport d'énergie supplémentaire. Elles sont initiées de l'extérieur. On distingue :
- l'activation thermique : un atome ou une molécule possédant suffisamment d'énergie (partenaire de choc) forme des espèces activées lors de collisions — par exemple, une flamme forme des radicaux ;
- l'activation par irradiation : l’utilisation de rayonnement (ultraviolets généralement) rompt les liaisons et forme des espèces réactives — par exemple, le peroxyde de benzoyle est un initiateur de radicaux très sensible aux UV ;
- l'activation chimique : un acide ou une base suffisamment forte forme un anion ou un cation instable — par exemple, le BuLi forme des carbanions utilisés pour la polymérisation anionique.
- Une ou plusieurs étapes de transfert : facultatives, elles consistent en un échange entre une espèce instable et une espèce stable — par exemple, un échange de charge électrique.
- Une ou plusieurs étapes de propagation : elles combinent des radicaux entre eux ou avec d'autres espèces pour former des produits, qu’ils soient intermédiaires ou finaux. Ces étapes peuvent se répéter tant que les réactifs sont présents.
- Une ou plusieurs étapes de terminaison ou d’inhibition : au cours de ces étapes, les intermédiaires réactionnels (radicaux…) se recombinent en formant des espèces stables. Ces étapes provoquent l'arrêt de la réaction et limitent le rendement.
- Mécanismes usuels
On distingue :
- les mécanismes en chaîne, caractérisés par la formation d'intermédiaires susceptible de réagir à nouveau ;
- les mécanismes radicalaires, qui font intervenir des radicaux ;
- …
Loi de van 't Hoff
La loi de van 't Hoff — à ne pas confondre avec l'équation de van 't Hoff en thermodynamique — relie le mécanisme chimique à la cinétique d'une réaction :
Pour une étape élémentaire, les ordres partiels sont égaux aux nombres stœchiométriques.
| Attention ! Cette égalité n'est généralement pas vérifiée pour des réactions qui ne sont pas élémentaires ! |
Par exemple, dans la réaction élémentaire:
les ordres partiels sont 1 pour le dihydrogène et 2 pour l'atome de brome, soit un ordre global de 3 pour la réaction.
Approximation des états quasi-stationnaires
Sauf quelques exceptions, on fait souvent l'hypothèse suivante au sujet de ces réactifs :
L’approximation des états quasi-stationnaires, ou approximation de Bodenstein, consiste à considérer que la vitesse de formation des espèces très réactives (radicaux, ions, …) est égale à leur vitesse de disparition. En d’autre termes, il est supposé qu’ils sont consommés aussitôt qu’ils sont formés, d'où une concentration nulle.
| Attention ! Certains radicaux, stables, ne vérifient pas cette hypothèse. C'est notamment le cas de nombreuses molécules « anti-âge » qui, en se recombinant avec des radicaux « libres », les neutralisent. |
Pour de nombreux intermédiaires radicalaires, cependant, la durée de vie est faible :
- (radical méthyl) survit environ 5 ms ;
- environ 10 ms ;
- de 0,1 à 1 ms ;
Il est possible de détecter des radicaux par différentes méthodes, généralement indirectes, comme le « miroir de plomb » de Paneth (1929) qui a démontré l’existence du radical méthyl.
Étape cinétiquement déterminante
Les étapes au sein d'un mécanisme peuvent être plus ou moins rapides.
On appelle étape cinétiquement déterminante (ECD) l'étape la plus lente d'un mécanisme (celle dont la constante de vitesse est la plus faible).
| On ne peut jamais appliquer l'AEQS à un composé impliqué en tant que réactif dans une ECD ! |
Une ECD possède généralement le dernier mot sur la cinétique d'une réaction, c’est elle que l’on vise à améliorer par l’utilisation de solvants ou de catalyseurs adaptés. Certains mécanismes ne possèdent pas d'étape significativement plus lente que les autres, aussi la notion d'ECD n’est pas systématiquement utile.
Les mécanismes peuvent parfois être observés. La cinétique permet d'éliminer certains mécanismes, mais ne peut pas distinguer plusieurs propositions équivalentes. Comme nous allons le voir, connaître le mécanisme d'une réaction permet d’établir la loi de vitesse associée.
Chemin réactionnel
Au cours d'une réaction, chaque étape nécessite une certaine énergie pour se produire. Cela joue un rôle du point de vue cinétique.
Le chemin réactionnel d'une réaction est une représentation, abstraite ou non, de l'évolution suivie par les réactifs entre l'état initial et l'état final.
On appelle coordonnée de réaction une variable abstraite qui parcourt le chemin réactionnel (c'est-à-dire qui varie de manière continue et strictement croissante entre l'état initial et l'état final de la réaction considérée).
Le chemin réactionnel peut être un « véritable » chemin, bien que ce ne soit souvent pas le cas. La coordonnée de réaction peut être, selon le cas considéré : le temps, la distance entre molécules (cas d'une dissociation), le nombre de liaisons (lorsqu'on en forme)… Parfois, choisir une coordonnée de réaction est difficile. Néanmoins, elle permet de se représenter ce qui se passe pendant la réaction : elle parcourt le chemin réactionnel.
Le tracé de l'énergie en fonction de la coordonnée de réaction est appelé diagramme de réaction.
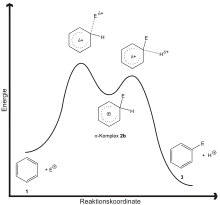
Un diagramme de réaction présente généralement les caractéristiques suivantes :
- les réactifs sont sur un palier d'énergie au début de la réaction (à gauche) ;
- les produits sont sur un palier d'énergie à la fin (à droite) ;
- entre les deux extrémités, une ou plusieurs « collines » : des pics d'énergie qu’il faut franchir pour effectuer la réaction, qui correspondent à la formation d'intermédiaires réactionnels instables (complexes activés).
Cette représentation permet une vision très intuitive du processus chimique : il s'agit de gravir le ou les pics pour passer la « montagne ». Généralement, l'énergie nécessaire pour réaliser cela est fournie par l'agitation thermique : plus la température est élevée, plus les réactifs possèdent d'énergie pour effectuer la réaction.
Parfois les espèces sont très réactives et dans ce cas, le diagramme de réaction ne présente pas de sommet (la réaction est spontanée et n'a pas besoin d'une énergie d'activation Ea).
- - Lorsque les produits sont sur un palier d'énergie à la fin plus bas que celui des réactifs, on a une réaction exothermique.
- - Lorsque les produits sont sur un palier d'énergie à la fin plus haut que celui des réactifs, on a une réaction endothermique.
Énergie d'activation et loi d'Arrhénius
On appelle énergie d'activation d'une réaction l'énergie nécessaire pour la réaliser.
On peut alors comprendre le résultat semi-empirique d'Arrhénius :
La constante de vitesse d'une réaction chimique varie avec la température, de la manière suivante :
avec Ea l'énergie d'activation de la réaction et A le facteur préexponentiel.
Il s'agit d'un résultat « semi-empirique » car la loi expérimentale formulée par Arrhénius a depuis trouvé une justification théorique, que l’on mentionne à titre culturel : l'équation d'Eyring-Evans-Polanyi. Il s'agit d'un résultat théorique, qui montre que la loi d'Arrhénius est une conséquence des lois de la thermodynamique :
avec l'enthalpie libre d'activation, h la constante de Planck et la constante de Boltzmann.
Cette loi d'Arrhénius ne peut pas être appliquée à toutes les réactions. Une loi plus générale s'écrit:
où peut être positif, négatif ou nul.
Exemple classique : synthèse de HBr
Chaque étape possède donc sa propre loi cinétique avec sa propre constante de vitesse. Pour illustrer ce principe, abordons l'exemple très classique de la synthèse du bromure d'hydrogène HBr.
- Mécanisme réactionnel
L'équation bilan s'écrit :
Quelques remarques préliminaires :
- Le composé M est appelé « partenaire de choc » : il s'agit d'un porteur d'énergie (paroi, atome, photon…) susceptible de former un radical par collision avec le dibrome ;
- Il s'agit ici d'un mécanisme radicalaire : c’est la formation de radicaux qui est responsable de la réaction ;
- Il s'agit ici d'une réaction en chaîne : des radicaux formés aux étapes 3 et 4 peuvent servir dans les étapes précédentes, prolongeant la réaction.
- Loi de vitesse
Dans un premier temps, écrivons la loi de van 't Hoff pour chacune des cinq étapes du mécanisme :
Ensuite, appliquons l'AEQS aux radicaux :
Enfin, on définit la vitesse de la réaction comme la vitesse d'apparition de HBr :
- Résolution mathématique
Les deux équations tirées de l'AEQS montrent que c'est-à-dire :
d'où :
D'autre part, l'AEQS pour le radical H· indique que , c'est-à-dire que :
d'où l’on tire :
Il suffit pour terminer de remplacer les expressions pour les radicaux dans , on obtient :
Pour plus de commodité — et puisqu'on aboutit à des lois similaires dans d’autre cas — on introduit k et k’ de sorte que :
- Discussion
Nous aboutissons à une loi de vitesse, qui nous donne plusieurs indications :
- Cette réaction n'a pas d'ordre ;
- La loi de vitesse obtenue dépend du produit formé ;
- Cette loi dépend de deux constantes de réaction ;
- …
Observons toutefois que, dans le cas où la concentration en HBr est faible devant la concentration en Br₂, la loi de vitesse peut être simplifiée :
Dans ce cas, la réaction est d'ordre . Puisque l’on forme HBr, ce résultat n'est valable que dans les tout premiers instants de la réaction, on parle d’ordre initial.
D'autre part, lorsque HBr est formé en quantités non négligeables, il a tendance à s'opposer à la réaction, qui atteint une vitesse limite :
- voir aussi: Thermodynamique des réactions chimiques