Généralités
Le couple rédox : ![]()
- Pour les alcools primaires :
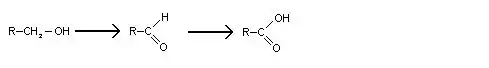
- Pour les alcools secondaires :
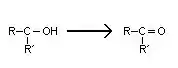
- Les alcools tertiaires ne sont pas oxydés.
Les aldéhydes peuvent s'oxyder en acides carboxyliques. Pour s'arrêter à l'alcool, il faut éliminer l'aldéhyde au cours de sa formation (par distillation par exemple).
Oxydation par les composés du manganèse
On utilise le couple MnO4-/Mn2+ en milieu acide et MnO4-/MnO2 en milieu basique ou neutre. Mais il est très difficile de s'arrêter à l'aldéhyde depuis l'alcool primaire avec cette méthode.
Oxydation par les composés du chrome VII
Oxydants utilisés :
- Mélange sulfochimique : Na2Cr2O7 + H2SO4 + H2O
- Réactif de Jones : CrO3 + H2SO4
- Méthode de Sarret : CrO3 + Pyridine
- Réactif de Collins : CrO3 + Pyridine2 dans CH2Cl2
Le réactif de Jones est utilisé pour de longues chaînes carbonées (plus de 10 carbones). Les composés chromés sont polluants et chers.
Autres méthodes
On utilise comme oxydant l'oxygène de l'air et un catalyseur solide chauffé (souvent du cuivre). Cette méthode est plus utilisée en industrie.
L'oxydation biologique à partir de l'oxygène de l'air à partir d'une enzyme naturelle, c’est la fabrication du vinaigre (acide éthanoïque) à partir du vin (éthanol).