Techniques d'extraction d'espèces chimiques
Nous utilisons ou consommons au quotidien des produits qui résultent d'une extraction d'espèces chimiques et cela depuis l'Antiquité.
Les parfums, les colorants, les arômes, en cosmétique, en médecine
Voici quelques techniques d'extraction "traditionnelles" :
- Le pressage : (Jus d'orange)
Les Égyptiens écrasaient des fleurs pour en extraire le parfum (espèce chimique).
- La décoction : (Teinture)
On place la plante dans l'eau froide et l’on porte à ébullition.
- L'infusion : (Thé)
On fait tremper les végétaux finement divisés dans l'eau bouillante.
- La macération : (Fruits dans l'alcool)
On laisse séjourner la substance à froid dans un solvant organique.
- L'enfleurage : (Parfum)
Les fleurs sont étalées sur de la graisse (animale), les odeurs (espèces chimiques) des fleurs "passent" dans la graisse.
Toutes les extractions précédentes sont réalisées à partir de produits naturels. Le solvant permet d'extraire une ou plusieurs espèces chimiques d'un solide.
Remarque : En pratique on extrait une substance chimique à partir d'un liquide (le solvant).
Principe de l'extraction par solvant
Principe général
L’extraction par un solvant consiste à faire passer, par solubilisation (dissolution), la substance à extraire dans un solvant
Solution, soluté, solvant
Lorsque l’on verse du sel dans l'eau, on obtient une solution d'eau salée.
Le sel est le soluté (il va être dissout dans l'eau).
L'eau est le solvant.
Miscibilité, solubilité, densité et masse volumique
L'extraction par solvant repose sur quatre notions : la miscibilité, la solubilité, la densité et la masse volumique.
Miscibilité
Qualité de ce qui peut se mêler, s’allier, se mélanger
L'eau et l'huile ne sont pas miscibles. Il y a deux phases si on les met dans le même récipient
L'eau et l'alcool sont miscibles, lorsqu'on les mélange, on n'observe qu'une seule phase.
L'extraction par solvant repose sur ce principe ; en effet l'espèce chimique à extraire doit être miscible avec le solvant (c'est-à-dire qu’ils doivent pouvoir se mélanger). Ensuite on récupère la phase {solvant + espèce chimique} puis on sépare le solvant et l'espèce chimique.
Solubilité
Masse maximale de soluté que l’on peut dissoudre dans un litre de solvant. La solution est alors saturée.
Elle s'exprime en g.L⁻¹
Reprenons l'exemple de l'eau et du sel : si on dispose d'un verre d'eau rempli au quart, et que l’on verse du sel, après une certaine quantité de sel versée, celui-ci ne continuera plus à se dissoudre. La solubilité est la limite d'"absorption" du solvant.
Cette caractéristique est importante, car il faut que les espèces chimiques à extraire soient plus solubles avec le solvant (ici la solubilité peut être comprise comme l'affinité).
Masse volumique
La masse volumique ρ (rho) d'une substance est le quotient de sa masse m (en kilogramme, kg) par son volume V (en m³), elle s'exprime donc en kg/m³ ou
Densité
La densité des liquides et des solides se mesure par rapport à l'eau, la densité des gaz se mesure par rapport à celle de l'air. C’est le rapport de la masse d'un volume de l'espèce chimique par la masse du même volume d'eau.
or d’après la masse volumique, on a :
masse espèce chimique :
masse eau :
d'où :
Le volume se simplifie, ce qui donne :
La densité n'a donc pas d'unité.
On remarque qu'avec cette convention, la densité de l'eau est d=1.
Choix du solvant
Les différents solvants utilisés
L' eau est souvent utilisée mais il existe de nombreux solvants organiques comme :
- le dichlorométhane
- l'éthanol ("l'alcool")
- le cyclohexane
- l'éther de pétrole
- le toluène
- le pentane
Un composé chimique est dit organique lorsqu’il renferme au moins un atome de carbone lié, au moins, à un atome d'hydrogène.
Les propriétés des solvants
- L'espèce chimique à extraire doit être la plus soluble possible dans le solvant
- Après extraction, on peut évaporer le solvant, sa température d'ébullition doit donc être basse.
- Le solvant doit être le moins dangereux possible.
- Lorsque l'espèce chimique à extraire est dans une phase aqueuse, le solvant ne doit pas être miscible dans l'eau.
Phase aqueuse : Phase contenant en solution dans l'eau divers additifs d'origine végétale, minérale ou synthétique.
Miscible : Qui peut se mélanger.
Soluble : Qui peut être dissout.
Deux exemples d'extraction
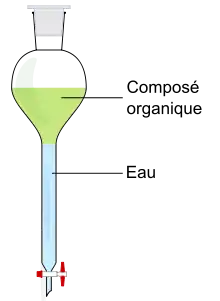
Extraction à partir d'un produit naturel
L'extraction à partir d'une substance naturelle est appelée extraction directe. La substance contenant les espèces chimiques à extraire est laissée directement dans un solvant (la macération, la décoction et l'infusion sont des extractions directes). Il suffit ensuite de séparer le solvant de la substance par filtration (ou décantation solide-liquide).
Extraction d'une espèce chimique à partir d'un liquide : exemple de l'eau
Cette extraction est aussi appelée extraction liquide-liquide.
Une espèce chimique peut être en solution dans l'eau, ou mélangée à celle-ci. Il est alors difficile d'extraire directement l'espèce chimique. On utilise alors un solvant organique pour extraire l'espèce chimique. Celle-ci va passer de l'eau au solvant. On aura alors deux phases non miscibles : la phase organique et la phase aqueuse.
Pour réaliser une extraction liquide-liquide, on utilise une ampoule à décanter.
L'hydrodistillation
Principe

1. Bec bunsen (pour chauffer)
2. Ballon
3. Tour de distillation
4. Thermomètre
5. Sortie de l'eau froide
6. Réfrigérant à eau
7. Entrée de l'eau froide
8. Erlenmeyer
Une hydrodistillation est une distillation d'un mélange d'eau et d'un produit naturel (feuilles, tige, écorce, etc.). Elle consiste à porter à ébullition ce mélange ; les vapeurs sont ensuite condensées afin de récupérer les substances à extraire.
On fait chauffer certaines parties des plantes (feuilles ou fleurs par exemple) dont on veut extraire les huiles essentielles, en présence d'eau.
Grâce à la chaleur, les cellules renfermant les huiles essentielles éclatent ; ces substances odorantes sont généralement volatiles et sont entraînées avec la vapeur d'eau, jusqu'au réfrigérant où la vapeur d'eau et les huiles essentielles se condensent ; on récupère alors ce distillat qui est formé de deux phases : une phase aqueuse, contenant l'eau, et l'huile essentielle.
volatil : Qui vole, qui peut voler, s'évaporer.
Qu'est-ce qu'une huile essentielle ?
C'est un ensemble de substances volatiles extraites d'un végétal. Elles peuvent être extraites des feuilles, des fleurs, des baies, de la tige, du tronc, de l'écorce, etc.
L'espèce majoritaire est appelée principe actif.
La teneur en huiles essentielles dans une plante est de l’ordre de 1 à 3%.
Généralement ces huiles essentielles sont :
- odorantes,
- huileuses,
- peu solubles dans l'eau,
- moins denses que l'eau (la phase organique se trouve donc souvent au-dessus de la phase aqueuse),
- toxiques à forte dose,
- altérables en présence d'air (c'est pourquoi un parfum ne sent pas éternellement lorsqu'on se parfume).
Liens
- Wikipédia