Sarcomère
Le sarcomère (étymologie : du grec σαρκο sarco désignant la chair, et μεροσ meros, partie) est l'unité de base des myofibrilles des muscles striés (squelettique et cardiaque). Les sarcomères sont des agencements de plusieurs protéines composés de trois systèmes différents de filaments.
- Le système de filaments épais est formé à partir d'une protéine appelée myosine (de type 2, car organisée en faisceau).
- Le système de filaments minces est fait de monomères d'actine. Les filaments minces s'insèrent sur la ligne Z mais ne la traversent pas, il s'agit de filaments différents de chaque côté.
- Le système élastique de filaments est composé d'une protéine géante, la titine (aussi appelée connectine). Cette protéine est enchâssée sur le myofilament épais, et va jusqu'à la ligne Z.

La fibre musculaire d'un biceps peut contenir plus de 100 000 sarcomères. Les myofibrilles des muscles lisses ne sont pas regroupées en sarcomères.
Structure
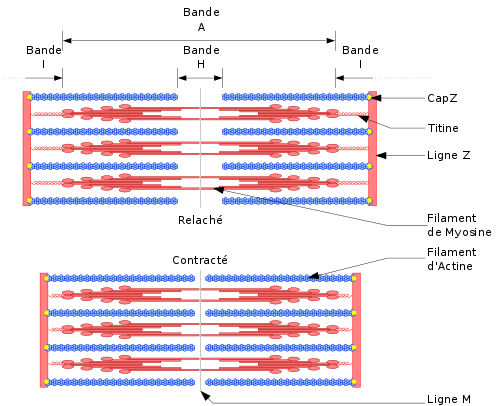
Le découpage en bandes
Les sarcomères sont les agents responsables de l'apparence striée des muscles des membres squelettiques et cardiaques. On définit un sarcomère comme étant le segment entre deux lignes-Z voisines. Dans les coupes longitudinales des muscles en microscopie électronique, les lignes-Z (de l'allemand zwischen, signifiant "entre") apparaissent comme une série de lignes foncées. À côté de la ligne-Z, on retrouve la bande-I (pour isotropique). La bande-A (pour anisotropique) vient ensuite. On retrouve une partie plus pâle dans cette région appelée la zone H (de l'allemand heller, plus pâle). Finalement incluse dans cette dernière, la mince ligne-M (de l'allemand mittel, centre) se situe à l'intérieur. Les bandes A et I ont été nommées d'après leurs propriétés sous microscope polarisant. Les bandes A et I, ainsi que la ligne Z, sont visibles au microscope optique.
Localisation des principaux composants du sarcomère
- La protéine géante titine va de la ligne Z à la ligne M. C'est la plus grosse protéine "simple" à l'état naturel. C'est une protéine élastique possédant de nombreux sites de liaison aux autres protéines du cytosquelette. Elle joue un rôle structural majeur au niveau du sarcomère, pour son assemblage et le maintien de sa structure.
- L'alpha-actinine constitue la ligne Z.
- Les filaments d'actine sont les composantes principales des bandes I (filaments minces) et s'étendent jusqu'aux bandes A. Ils sont reliés à la titine dans la ligne Z via la protéine alpha-actinine.
- Les filaments de myosine (filaments épais) se retrouvent à travers la bande A et se superposent dans la bande M (au centre du sarcomère). Ils sont liés à ce niveau à la titine via les protéines myomésines et protéines M.
On retrouve plusieurs protéines importantes pour la stabilité de la structure du sarcomère dans la ligne Z et la bande M.
Fonction : la contraction

Modèle de contraction du sarcomère
L'interaction entre l'actine et la myosine dans la bande A du sarcomère est responsable de la contraction du muscle, suivant le modèle des filaments glissant les uns sur les autres. L'actine joue le rôle de la molécule tractée, et la myosine est le moteur moléculaire, qui tire les filaments d'actine vers la bande M. Cela se déroule en 5 étapes:
- À l'état inactif, le domaine d'interaction avec l'actine de la myosine est recouvert par la tropomyosine. La myosine est sous une forme redressée, de haute énergie, liée à l'ATP.
- Lorsque la cellule musculaire striée squelettique est stimulée par un motoneurone (via le neurotransmetteur acétylcholine), il y a activation de canaux calciques voltage-dépendants, ce qui provoque l'entrée de calcium dans la cellule. On a également sortie de calcium du réticulum sarcoplasmique (la forme musculaire du réticulum endoplasmique). Ce calcium vient se fixer sur la troponine ce qui provoque un changement de conformation de cette dernière, libérant le domaine d'interaction de la myosine. Au terme de cette étape la myosine est fixée à l'actine.
 Schéma actine, myosine, troponine, tropomyosine
Schéma actine, myosine, troponine, tropomyosine - Lors de l'interaction myosine-actine, la molécule d'ADP fixée sur la tête de la myosine est libérée, ce qui provoque un changement de conformation et bascule la tête de myosine. Ce basculement tracte l'actine vers la bande M, provoquant un raccourcissement du sarcomère.
- Au terme de ce mouvement, la tête de myosine lie une molécule d'ATP ce qui provoque son détachement de la molécule d'actine et le retour à une position repliée, de basse énergie.
- Elle hydrolyse son ATP en un ADP plus un ion phosphate, et l'énergie libérée par cette réaction fait passer la myosine a un état de haute énergie, capable d'interagir avec l'actine. La troponine peut à ce moment empêcher cette interaction si elle n'est plus fixée au calcium. Le cycle est terminé et peut recommencer.
C'est ainsi que des milliers de têtes de myosine réalisant ce cycle parviennent à raccourcir la taille du sarcomère de 3,4 µM (forme étirée) à 2,4 µM (forme contractée).
Conséquences sur la cellule musculaire, et sur le muscle
Les conséquences d'un raccourcissement pouvant aller jusqu'à 1µm par sarcomère est évidente: si l'on multiplie ce raccourcissement par le nombre de sarcomères présents dans une cellule musculaire striée squelettique (jusqu'à 100 000 pour les plus grands muscles), on arrive à un raccourcissement de la cellule d'au maximum 10 cm. Les cellules musculaires pouvant être de la taille du muscle, le raccourcissement du muscle est de taille équivalente. Cependant une fibre seule n'est pas suffisante pour permettre la contraction d'un muscle: il faut que l'ensemble des fibres musculaires d'un muscle soient activées simultanément par les motoneurones. Pour que cette contraction musculaire aboutisse à un mouvement, le muscle antagoniste doit être au repos.
Voir aussi
- Nebuline, protéine se liant à l'actine
- Myopalladine, une autre protéine musculaire
Sources
- rubrique "Actine/Actine dans les cellules musculaires"
- Vulgarisation du phénomène de contraction musculaire (avec dictionnaire interactif consultable en parallèle)
- Portail de la biologie cellulaire et moléculaire