Plasticité synaptique
La plasticité synaptique est la propriété que les connexions entre les neurones, appelées synapses, ont de changer en force en fonction de l'usage qui en est fait[1]. Elle englobe les multiples mécanismes intervenant dans la modification de la transmission synaptique au cours du temps. En effet, la connexion entre deux neurones n'est pas figée, comme on le pensait il y a 50 ans, mais dépend des activités antérieures des neurones et de leur « utilisation » de cette connexion. La plasticité synaptique est considérée comme une sous-partie d'une propriété plus large du réseau neuronal et du cerveau en général, la plasticité neuronale (ou cérébrale). Néanmoins, cette forme de plasticité à l'échelle de la connexion permet d'expliquer de nombreuses formes de mémoire simple présentes chez tous les individus présentant un système nerveux, même peu développé.
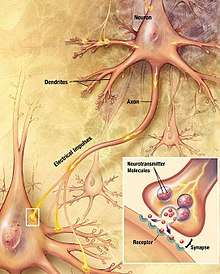
Codage et modulation de la transmission synaptique
Au niveau d'une synapse, un potentiel d'action provenant de l'axone du neurone présynaptique provoque la libération de Neurotransmetteurs dans la fente synaptique (sous forme de vésicule). Ces derniers interagissent avec leurs récepteurs correspondants au niveau de la membrane du neurone postsynaptique. Qu'ils soient métabotropes ou bien récepteurs ionotropes, les récepteurs activés génèrent un courant postsynaptique par l'ouverture de canaux ioniques.
Le signal obtenu en sortie est codé par l'amplitude de la dépolarisation. Celle-ci est dépendante de plusieurs paramètres intervenant aux trois niveaux de la synapse, présentés ici de manière non-exhaustive :
- Espace présynaptique : fréquence des potentiels d'action (exprimé en Hz), quantité de neurotransmetteurs relargués par vésicule
- Fente synaptique : nature et concentration du neurotransmetteur (exprimé en concentration molaire, ainsi qu'une implication non négligeable des astrocytes de leur rôle dans la régulation de la transmission nerveuse)
- Espace postsynaptique : nombre et efficacité des récepteurs post-synaptiques
La plasticité synaptique résulte alors d'un changement quantitatif des différents paramètres de codage en entrée et en sortie, c’est-à-dire qu'il y a deux plasticités possibles, une plasticité présynaptique et une plasticité postsynaptique.
Mécanismes biologiques
Modélisation mathématique
Processus d'interactions synaptiques et plasticités
Depuis les découvertes des années 1960 de Eric Kandel (prix Nobel de médecine en 2000), la recherche en neuroélectrophysiologie met à jour régulièrement de nouveaux types de plasticités synaptiques. Celles-ci se déclinent en de multiples formes, dont les cardinales sont:
- habituation,
- sensibilisation (ou désensibilisation),
- potentialisation
- dépression.
Chacun de ces phénomènes comprend des variantes classées en sous-types. À l'heure actuelle, il est évident qu'on ne peut se prétendre exhaustif dans l'énumération des différents types et sous-types de plasticité constatés, puisqu'on n'a pas encore entièrement compris quelle logique englobante régit leur apparition. Il se peut que les variantes de plasticité soient quasi illimitées et que la fréquence de leur apparition respective soit en rapport direct avec le type de neurones qu'elles modifient, ainsi qu'en fonction de leur environnement cellulaire.
Habituation
La réponse post-synaptique s'atténue au fil des stimuli constants et répétés provenant des afférences : c'est la forme la plus simple d'apprentissage, elle consiste à ignorer un stimulus insignifiant et inoffensif. On distingue l'habituation à court terme : 1' de stimulation ⇒ 2 h. d'activité. On constate une diminution de l'activation des canaux Ca2+ présynaptiques. L'habituation à long terme peut durer jusqu'à 3 semaines. Mais la stimulation ne doit pas être intense mais progressive. Les conséquences morphologiques et structurales au niveau de la terminaison pré-synaptique des neurones déchargeant constamment sont : moins de vésicules, moins de synapses, pertes de contacts et d'activité.
Sensibilisation
Classiquement, une première sommation sensorielle brusque et inopinée (stimulus inconditionné, douloureux) induit des réactions plus vives face à divers stimuli sensoriels neutres (état d'hypervigilance, d'alerte). C'est une sensibilisation.
En effet, la voie de ce stimulus (un neurone sensitif/nociceptif) active sur son trajet un neurone à sérotonine (5-HT), un neuromodulateur facilitant. Celui-ci forme une première synapse axono-synaptique, avec le bouton présynaptique. En effet, en position présynaptique, se trouve un autre neurone qui conduit un input neutre (Conditional Stimulus) vers un centre intégratif sensoriel (ou un motoneurone/interneurone, s’il s’agit d’une boucle réflexe) qui, lui, représente le neurone postsynaptique. Avec la libération de la 5-HT au niveau de la première synapse (i.e. entre l’axone du neurone modulateur 5-HT et le bouton de la synapse du neurone présynaptique glutamatergique), une potentialisation importante a lieu au niveau de la synapse « principale » (pré-postsynaptique). Il y a donc, sans compter le neurone du US, 3 acteurs cellulaires au niveau de cette synapse : 2 présynaptiques, et 1 postsynaptique. La 5-HT va agir sur des récepteurs 5-HT sur le neurone présynaptique, et induire un pic d'AMPc qui conduit à une diminution de l'activité des canaux K+. Ainsi, la synapse devient plus sensible, et la dépolarisation persiste, ce qui implique une libération accrue de Glutamate (le neurotransmetteur) sur la cellule post-synaptique, sans qu’il n'y ait de composante postsynaptique activée dans ce phénomène, i.e. en l’occurrence que le neurone du centre intégratif sensoriel ne soit activé.
Il existe également une forme à court terme et à long terme.
Potentialisation
La potentialisation à long terme (PLT) a lieu grâce aux récepteurs NMDA, canaux calciques « détecteurs de coïncidence » et aux récepteurs AMPA « amorceurs » (en général : car les GABAAr sont, avant d’être inhibiteurs pendant la vie adulte, responsables de la consolidation des premières synapses excitatrices dans le développement embryonnaire du cerveau, i.e. amorcent la préstimulation des récepteurs NMDA). Une molécule-cible pourrait être la CaMKinase II, cible de la Calmoduline complexée au Calcium, existant sous forme de 4 sous-unités de CaMK. La demi-vie d'une CaMKII phosphorylée étant d'environ 10 secondes, elle reste active encore longtemps après la fin du pic calcique et est supposée transformer les fréquences en intensité, ou l’impulsion initiale en inertie au sein de la cellule ; elle jouerait le rôle de « protéine redresseuse de courant ». En outre, certaines isoformes de la CaMKII migrent du cytosol au noyau, et semblent jouer un rôle dans l’activation de la transcription des gènes précoces CRE-dépendants.
On distingue plusieurs types de PLT :
- Plasticité hebbienne homosynaptique (activité-dépendante), associative (conditionnement)[2] : « associative » signifie que les décharges du neurone présynaptique sont synchronisées avec celle du neurone postsynaptique, et « homosynaptique » qu’il y a deux acteurs cellulaires de même nature (ex. : neurones glutamatergiques) au niveau de la synapse.
- La PLT précoce est inductible avec un unique stimulus à 100 Hz (tetanus) qui active des kinases (ex. : CaMKII) : ne dure pas plus que quelques heures.
- La PLT tardive est persistante (dure environ 24 h) et nécessite par contre un très fort stimulus tétanique voire plusieurs pour être induite, avec élévation de la concentration intracellulaire d'AMPc et recrutement de plusieurs kinases, comme PKA et MAPK qui active la transcription de CREB la plupart du temps (mais d’autres facteurs de transcription semblent certaines fois être activés à la place de CREB[3]. La PLT persistante est corrélée avec la mémoire à long terme, notamment dans l'hippocampe.
N.B. : Entrées modulatoires induisant une PLT : des neuromodulateurs tels que la dopamine (agonistes D1/D5) augmentent les taux d'AMPc et induisent la PLT des neurones glutamatergiques (Schaffer Coll Pathw., cf. Kandel et Bach)... D'où on pourrait inférer que la plasticité hétérosynaptique et la sensibilisation sont toutes les deux efficaces pour induire la PLT hebbienne classique dans l'hippocampe.
La Plasticité hétérosynaptique (input à modalité dépendante) : processus non associatif indépendant de l’activité de la synapse. 3 intervenants synaptiques (idem sensibilisation mais) tous glutamatergiques : un neurone présynaptique, un neurone modulateur axono-synaptique présynaptique, et un neurone postsynaptique. Une synapse peut donc être renforcée ou affaiblie sans la nécessité d’une activité pré ni postsynaptique, mais uniquement du neurone modulateur jouxtant le bouton présynaptique de la synapse (Kandel). L’effet renforçant du neurone modulateur se trouvera augmenté si son activité coïncide avec celle du neurone présynaptique. Ce genre de plasticité active l'expression du senseur intracellulaire CREB qui induit des changements à long terme en matière de transcription de gènes responsables de l'engramme (mise en mémoire des événements), bien plus fréquemment que la plasticité hebbienne (selon Kandel). En effet la plasticité hétérosynaptique est nécessaire mais aussi suffisante pour activer la transcription. Ceci peut conduire à la croissance/rétraction d’un cône axonal, par exemple.
N.B. : Modulatory Inputs inducing LTP (suite) : des axones provenant du locus cœruleus (NA), du raphé dorsal (5-HT), et du VTA (DA) longent les Schaffer Coll, les fibres moussues, les voies perforantes et les voies cortico-amygdaliennes et sont capables de modifier la PLT à leur niveau (Kandel). « The increased release of glutamate might lead to its spillover to presynaptic glutamate receptors on the terminals of the NA and DA axons, causing the release of these NM independently of activity in the modulatory axons themselves » (Kandel about Whitton P.S. paper: 1997 in Neurosci.Biobehav. Rev.). Further Kandel postulates that maybe Hebbian homosynaptic long term plasticity cannot persist per se, and modulatory transmitters can produce persistent changes by themselves, becoming necessary and sufficient also for Hebbian plasticity!
La Plasticité de PLT hétérosynaptique (PPLTPHA) : Humeau & Lüthi, Nature 2003 ; Associative (i.e. condition : synchronisation des 2 inputs présynaptiques) mais indépendante de l’activité postsynaptique (including depolarization, postsynaptic NMDA receptors activation or increase in post synaptic [Ca2+]). L’expression de la PLT se traduit en l’occurrence comme une augmentation persistante de la probabilité présynaptique de relâchement vésiculaire. Dans ce cas, il n’existe pas de neurone modulateur ; on est en présence de 3 neurones glutamatergiques. Le couplage entre une facilitation hétérosynaptique (n.1pré - n.2pré) et une activité homosynaptique (n.2pré - n.post) est responsable d’une augmentation des [cAMP]i¢ et du renforcement synaptique. Ce type de changements est plus important que la somme de ceux qui sont produits individuellement par des processus homo et hétérosynaptiques. Cette combinaison peut être considérée comme une nouvelle catégorie de plasticité (Kandel).
Métaplasticité: Abraham & Baer, Tr Neurosci. 1996 : changement dans la capacité d’induire une plasticité synaptique subséquente. La qualité du changement (PLT ou LTD p.ex.) n’est pas déterminée, c’est uniquement la réactivité/réceptivité aux stimuli présynaptiques qui est augmentée/varie.
ex. : 1 : La STP (short term potentiation) est induite facilement avec un « short burst » (30 Hz, 150 ms) dans la région CA1. En soi, un tel burst induit uniquement une STP transitoire qui diminue rapidement pour retourner à la baseline. Cependant, il semblerait qu’il existe bel et bien de « long-lasting effects of this seemingly innocuous activity », et ceux-ci sont apparents lors des essais ultérieurs de stimulation de la même cellule (dans le but d’induire une plasticité). Ces effets comprennent et une PLT, et une LTD, par des mécanismes sub¢ peu clairs (1996). ex. : 2 : L’induction de la PLT au niveau des Schaffer Coll. par un fort tetanus a été inhibée lorsqu’un tetanus plus faible (5 Hz) était administré préalablement sur le même input (Schaffer Collateral). L’effet était input specific et durait moins de 30 min. De plus, au fil des expériences, la première stimulation semble plutôt augmenter le seuil de stimulation nécessaire à induire la PLT, plutôt que de la bloquer complètement. Dans d’autres cas, avec la même « priming » stimulation (5 Hz), on assiste à une facilitation de la PLT lors du fort tetanus successif. C’est donc une plasticité de la plasticité synaptique. Selon l’auteur et ses expériences, la MP serait NMDAr-dépendante (« the priming stimulation »), donc h[Ca2+]i¢ dépendante, mais impliquerait aussi des récepteurs mGlu metabotropiques au glutamate ; et pourrait transformer p.ex une PLT en LTD !
Une des formes de potentialisation à long terme est la plasticité fonction du temps d'occurrence des impulsions.
Phénomènes/observations rattachés à la PLT
Synapses sourde, silencieuse ou discrète
- Sourde : l'espace postsynaptique est silencieux : incapable de détecter le glutamate car il ne présente pas de récepteur AMPA.
- Silencieuse : l'espace présynaptique est silencieux :
- Chuchotement : le relargage de glutamate est insuffisant pour susciter la réponse minimale quantique.
N.B.: Souvent la concentration de glutamate ne peut activer les récepteur NMDA ; s'ils ne sont pas présents, il ne se passe rien. [4]
Occlusion
Appelée également saturation. Il s'agit de la limite maximale ou Plafond de la Potentialisation (Potentiation) qui dépend de facteurs limitants tels que le nombre de récepteurs postsynaptiques ou la quantité de vésicules présynaptiques libérables, etc. L’occlusion de la PLT survient typiquement quand les NT (glu) ont saturé tous les récepteurs postsynaptiques (maximum effectif glutamatergique par unité de temps atteint).
2 cellules impliquées :
- Ex1 : Augmentation du nombre de vésicules libérées par stimulation électrique présyn plus intense p.ex : multiplication 3x (arbitraire) de la potentialisation jusqu’à atteindre la saturation des récepteurs postsyn. : utilisation de la marge existant entre le nbre de récepteurs et le nombre de NT.
- Ex2 : Le BDNF va induire une augmentation du nombre de récepteurs postsynaptiques; ce qui induit aussi une potentialisation 3x plus élevée, donc une occlusion 3x moins importante, si le nbre de NT libéré est suffisant pour occuper tous les récepteurs (anciens et nouveaux).
- Ex3 : Effet synergique si combinaison des 2 phénomènes Ex1 et Ex2 en même temps : multiplication des facteurs facilitants entre eux : 9x !! ⇒ occlusion atteinte 9x moins facilement.
1 cellule impliquée :
- Ex4 : un stimulus peut en occlure un autre au niveau de la même cellule : le st1 empêche l’expression du st2 en le précédant dans le temps : compétition dans l’utilisation de la machinerie cellulaire au profit du st1 : ceci se passe lorsque les 2 phénomènes ont lieu sur la même cellule, ex. : stimulation e- et BDNF : le premier stimulus entré en action va empêcher le second stimulus d’en faire de même, par surexploitation de la cellule : exemple : est-ce qu'un type de plasticité en occlut un autre sur la même cellule ? i.e. pour répondre à la question : est-ce que les 2 types de plasticité ont des acteurs communs au niveau de la cellule ?
Facilitation
Il s'agit de l'augmentation à court terme du nombre de vésicules exocytées à la suite d'un PA. Comme on pense que chaque vésicule contient la même quantité de neurotransmetteur, la concentration de neurotransmetteur dans la fente synaptique dépend principalement du nombre de vésicules qui ont libéré leur contenu. Or l'exocytose est provoquée par la brusque augmentation de la concentration intracellulaire de calcium qui suit un PA. Dans certain type de synapse, l'augmentation de la concentration calcique se somme quand les PA se succèdent à un certain rythme. Du coup, pour les PA finaux, le taux d'exocytose est plus important que pour les premiers. Sur des mesures des courants postsynaptiques, on observe typiquement de plus grandes amplitudes plus le neurone présynaptique décharge des PA longuement.
Dépression
Dépression à court terme
Dépression à long terme (DLT)
Dépression glutamatergique sur stimulation synaptique à basse fréquence, indépendante de l’inhibition GABAergique et dépendante des NMDAr.
Références
- L'adage anglais « use it or lose it! » (Vous le perdrez si vous ne l'utilisez pas) est couramment employé pour illustrer le phénomène.
- Bliss and Lømo, hippocampus 1973.
- Kandel et Gass P. et al. 1998.
- Voronin LL. and Cherubini E. 2004.