Monoxyde d'azote
Le monoxyde d'azote, oxyde azotique, oxyde nitrique ou NO est un composé chimique formé d'un atome d'oxygène et d'un atome d'azote. C'est un gaz dans les conditions normales de température et de pression. C'est un important neurotransmetteur chez les mammifères ; dissous, il franchit facilement les membranes biologiques et passe d'une cellule à l'autre, constituant un « messager paracrine idéal »[12].
| Monoxyde d'azote | |||
  Molécule de monoxyde d'azote |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | Monoxyde d'azote | ||
| No CAS | |||
| No ECHA | 100.030.233 | ||
| No EC | 233-271-0 | ||
| Code ATC | R07 | ||
| PubChem | 145068 | ||
| SMILES | |||
| InChI | |||
| Apparence | gaz comprime incolore[1]. | ||
| Propriétés chimiques | |||
| Formule brute | NO [Isomères] |
||
| Masse molaire[2] | 30,0061 ± 0,0005 g/mol N 46,68 %, O 53,32 %, |
||
| Moment dipolaire | 0,15872 D[3] | ||
| Propriétés physiques | |||
| T° fusion | −163,6 °C[1] | ||
| T° ébullition | −151,8 °C[1] | ||
| Solubilité | dans l'eau à 0 °C : 7.4 ml/100 ml[1] | ||
| Masse volumique | 1,3 kg·l-1 (liquide)
|
||
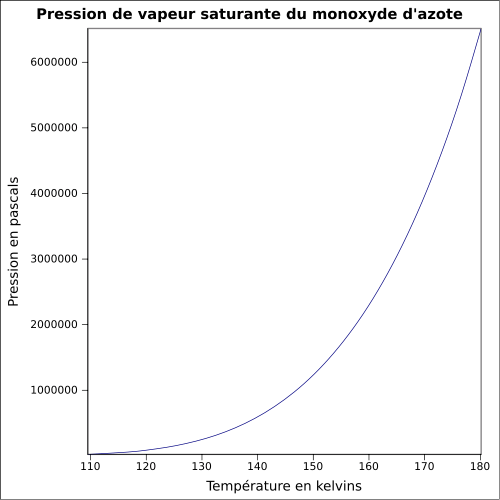
| Pression de vapeur saturante | |||
| Point critique | 65,8 bar, −93,35 °C[5] | ||
| Vitesse du son | 325 m·s-1 (10 °C,1 atm)[6] | ||
| Thermochimie | |||
| S0gaz, 1 bar | 211 J/Mol·K | ||
| ΔfH0gaz | 90,29 kJ·mol-1[7] | ||
| ΔfH0liquide | 87,7 kJ/Mol | ||
| ΔvapH° | 13,83 kJ·mol-1 (1 atm, −151,74 °C)[8] | ||
| Cp | |||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 9,26438 ± 0,00005 eV (gaz)[9] | ||
| Précautions | |||
| SIMDUT[10] | |||
    A, C, D1A, E, |
|||
| Directive 67/548/EEC | |||
 T+  C  O Phrases R : 8, 26, 34, Phrases S : 9, 17, 26, 28, 36/37/39, 45, |
|||
| Transport | |||
| Inhalation | Dangereuse, peut conduire à la mort | ||
| Peau | Irritant | ||
| Yeux | Peut causer des irritations | ||
| Ingestion | Utilisé à des fins thérapeutiques, mais présente des effets indésirables et est dangereux en surdosage | ||
| Écotoxicologie | |||
| Seuil de l’odorat | bas : 0,29 ppm haut : 0,97 ppm[11] |
||
| Unités du SI et CNTP, sauf indication contraire. | |||
Le monoxyde d'azote (NO), ne doit pas être confondu avec d'autres oxydes d'azote, tel le protoxyde d'azote N2O, que l'on appelle « gaz hilarant », et qui est un anesthésique général, ou encore tel le dioxyde d'azote NO2, gaz rouge-brun extrêmement irritant et nocif, qui se forme par oxydation rapide de NO par l'oxygène de l'air.
Sa grande réactivité (en phase soluble notamment) vis-à-vis des composés radicalaires comme l'oxygène moléculaire - qui est un biradical - ou l'anion superoxyde est due au fait qu'il est lui-même un composé radicalaire - son spin électronique total vaut 1/2. En milieu biologique, son temps de demi-vie est estimé entre 1 et 5 secondes[13], voire 30 secondes[14]. Les peroxynitrites obtenus sont de puissants agents oxydants et nitrants[15]. Ceci explique des effets ubiquitaires encore mal compris, allant de la réponse immunitaire aux agressions microbiennes et des processus inflammatoires au choc septique et à la mort neuronale en phase d'ischémie. Il est aussi impliqué dans les mécanismes cellulaires de l'apprentissage mémoriel, ou encore dans le phénomène de l'érection.

Production et effets environnementaux
Ce gaz peut être biosynthétisé en faibles quantités par de nombreux organismes, dont le corps humain[16].
Dans la nature, à haute température, le diazote et le dioxygène réagissent pour donner le monoxyde d'azote, par exemple sous l'effet de la foudre.
L'activité humaine a radicalement modifié la production de monoxyde d'azote dans la biosphère, en raison de la formation de grande quantité de ce gaz dans la chambre de combustion des moteurs à explosion, dans certaines chaudières et moteurs industriels et lors de certains processus de l'industrie chimique[17]. Un des buts des pots d'échappement catalytiques est d'inverser cette réaction et diminuer les émissions de ce gaz.
Propriétés[18]
Les propriétés chimiques du monoxyde d'azote sont très nombreuses. Ce qui suit est une bref survol de ses méthodes de préparation et de sa réactivité.
Préparation
Le monoxyde d'azote est formé à partir des éléments à haute température, comme indiqué plus haut.
Il peut être synthétisé au laboratoire selon les réactions d'oxydoréduction suivantes, où un dérivé azoté de degré d'oxydation supérieur à +II (acide nitrique : +V ; acide nitreux : + III) est traité par le réducteur adéquat. Toutes ces réactions doivent être mises en œuvre en l'absence d'oxygène, car celui-ci oxyde rapidement NO en dioxyde d'azote. :
Ainsi la réduction de l'acide nitrique dilué par le cuivre
- 8 HNO3 + 3 Cu → 3 Cu(NO3)2 + 4 H2O + 2 NO
ou celle de l'acide nitreux (formé in situ) par les ions iodure ou ferreux
- 2 NaNO2 + 2 NaI + 2 H2SO4 → I2 + 4 NaHSO4 + 2 NO
- 2 NaNO2 + 2 FeSO4 + 3 H2SO4 → Fe2(SO4)3 + 2 NaHSO4 + 2 H2O + 2 NO
La réaction précédente est une méthode simple permettant d'obtenir NO au laboratoire.
Le monoxyde d'azote peut également être obtenu en milieu anhydre grâce à la réduction de nitrates et de nitrites par le chrome(III) :
- 3 KNO2 (l) + KNO3 (l) + Cr2O3 (s) → 2 K2CrO4 (s) + 4 NO
La synthèse industrielle de NO consiste en l'oxydation de l'ammoniac par l'oxygène de l'air en présence de mousse de platine vers 750 à 900 °C.
Réactivité
Oxydoréduction

Le diagramme de Frost à pH = 0 de l'azote montre bien que le monoxyde d'azote est instable et qu'il devrait se dismuter en diazote N2 et acide nitrique HNO3. Il est en fait très facilement oxydé en dioxyde d'azote NO2, plus stable, par l'oxygène de l'air. C'est pourquoi on observe les vapeurs rousses de ce dernier gaz lorsqu'on oxyde le cuivre par l'acide nitrique concentré.
Une hypothèse plausible est que le biradical O2 se lie à deux radicaux NO pour donner ON-OO-NO, qui subit ensuite une rupture homolytique conduisant à NO2.
Cependant, en l'absence d'oxygène, il se dismute vers 50 °C en protoxyde d'azote N2O (gaz hilarant) et dioxyde d'azote NO2 (vapeurs rousses). À 25 °C, la vitesse de la réaction est pratiquement nulle, et NO y est métastable.
En solution aqueuse, NO se dissout pour donner de l'acide nitreux HNO2, selon le schéma réactionnel possible suivant :
- 4 NO + O2 + 2 H2O → 4 HNO2
NO réagit avec le fluor, le chlore et le brome pour donner des composés du type X-NO, connus sous le nom d'halogénures de nitrosyle. L'iode est trop peu oxydant pour donner lieu à la formation d'iodure de nitrosyle.
L'iodotrifluorométhane réagit avec NO pour donner un des rares gaz bleus connus, le nitrosotrifluorométhane :
- NO + CF3I → I2 + CF3NO
La vitesse de formation de l'ion peroxynitrite à partir du monoxyde d'azote et de l'ion superoxyde est de 1,9 × 1010 mol−1 s−1, ce qui implique la présence de peroxynitrite in vitro et in vivo au moindre excès de ses deux précurseurs[19].
Dimérisation

Contrairement au dioxyde d'azote, le monoxyde d'azote n'a pas tendance à se dimériser[20]. Ce comportement est attribué à la répartition de l'électron célibataire sur l'ensemble de la molécule, ainsi que sur le fait que la structure la plus probable O=N-N=O laisserait inchangée le nombre total de liaisons (2 × 2,5).
En phase liquide, une dimérisation partielle intervient. La forme C2v (cis) est plus stable que son homologue trans, et la forme C2h (molécule rectangulaire avec la liaison d'un atome d'azote d'une molécule avec un atome d'oxygène de l'autre, et réciproquement) n'est pas observée.
Des calculs ab inito SCF ont montré que la forme cis du dimère (NO)2 présenterait les distances d(N-N) = 174 pm et d(O-O) = 116 pm et un angle O-N-N = 107°[21]. Ces valeurs sont sensiblement différentes de celles déduites de données de diffraction de rayons-X en phase solide désordonnée (voir figure ci-contre)[22]. Cette disparité des valeurs confirme la difficulté d'étudier un dimère dont la formation est fugace.
Le monoxyde d'azote est aussi un ligand[23]
La molécule de monoxyde d'azote est apparentée à celle du monoxyde de carbone CO, avec la différence qu'il comporte un électron supplémentaire, qui occupe une orbitale antiliante. C'est ainsi que NO forme des complexes du même type que ceux formés avec CO, l'angle de la liaison M-N=O étant pratiquement égal à 180 ° - en réalité cet angle varie entre 160 ° et 180 °.
Ces complexes sont donc considérés comme linéaires. Dans ce cas, l'azote engage formellement son doublet libre dans la liaison de coordination. Cependant, l'azote est oxydé car il donne son électron célibataire au métal qu'il coordonne et qui est donc réduit. Ainsi les complexes tétracarbonylonickel, nitrosylotricarbonylocobalt et dicarbonylodinitrosylofer sont-ils isostructuraux (tétraédriques) car isoélectroniques.
NO peut former des complexes en ne donnant qu'un seul électron au métal. Cela conduit à un groupe M-N-O où l'angle de liaison est compris entre 120 ° et 140 °.
Il peut également jouer le rôle de pont entre deux centres métalliques par le biais de l'azote.
Réactions des complexes nitrosyle
La chimie des composés de coordination de NO est vaste et ne sera abordée que brièvement. Par exemple NO s'insère entre le niobium et un ligand méthyle dans la réaction suivante :

Caractérisation du NO coordiné
Les NO terminaux peuvent être reconnus par leur absorption infrarouge intense à 1 610 cm-1. Les nombres d'onde d'absorption IR des dérivés angulaires sont inférieurs.
Analyse quantitative
_(white)_in_the_cytoplasm_(green)_of_clusters_of_conifer_cells_one_hour_after_mechanical_agitation.jpg)
L'analyse quantitative la plus classique du monoxyde d'azote met en œuvre une simple réaction chemiluminescente avec l'ozone[24].
voir Mesure des oxydes d'azote
Un échantillon contenant NO est mélangé avec une quantité d'ozone en excès. Le monoxyde d'azote réagit en formant de l'oxygène et du dioxyde d'azote. La réaction libère aussi de l'énergie sous forme d'ondes électromagnétiques dans le visible : c'est la chemiluminescence. L'intensité de la lumière produite, mesurée grâce à un photodétecteur, est proportionnelle à la quantité de monoxyde d'azote. Un exemple d'application thérapeutique du NO est sa mesure dans l'air expiré des patients (asthmatiques pour la plupart). Le principe consiste à souffler dans un appareil de chemiluninescence et ainsi mesurer le NO exhalé et donc mesurer l'inflammation des voies respiratoires.
On peut également doser par diverses méthodes électrochimiques (potentiométrie avec le permanganate de potassium[25], polarographie)
Applications techniques
Fonctions biologiques[26]
NO est une molécule endogène libérée par les cellules endothéliales, les macrophages, les cellules du foie et les neurones.
Dans l'organisme le monoxyde d'azote remplit plusieurs fonctions.
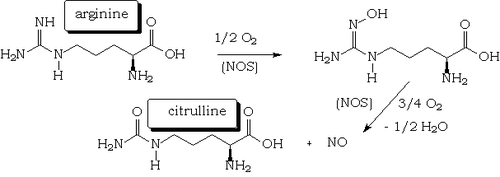
Il est synthétisé naturellement par le corps à partir de la L-arginine et de l'oxygène par plusieurs enzymes dites NO synthases (NOS), qui sont des hémoprotéines[27] proches du cytochrome P450. Le catalyseur de l'oxydation par l'oxygène du groupement iminourée de l'arginine est donc le fer de l'hème qui passe du degré d'oxydation + II aux degrés + III et + IV et vice-versa.
La liaison du NO aux thiols de bas poids moléculaire - tels que le glutathion - conduit à la formation de S-nitrosothiols qui constitueraient un déterminant important pour l’activité et le transport du NO. Ces composés peuvent subséquemment agir comme donneurs de NO et ainsi augmenter substantiellement sa demi-vie[28].
L'activité cellulaire du monoxyde d'azote passe par deux voies essentielles, celle qui consiste en la production de Guanosine monophosphate cyclique intracellulaire (GMPc) à partir de la Guanosine triphosphate (GTP), et la formation de peroxynitrites cytotoxiques[29]. L'augmentation de la concentration de GMP cyclique passe par l'activation d'une guanylate cyclase cytoplasmique (non membranaire).
Vasodilatateur
L'endothélium des vaisseaux sanguins se sert du NO pour déclencher le relâchement de sa tunique de muscle lisse, provoquant ainsi une vasodilatation et un accroissement du débit sanguin et une diminution de l'agrégation des plaquettes sanguines (thrombocytes). C'est le plus important des neuromédiateurs « non adrénergiques non cholinergiques »[30] ; il est à l’œuvre dans l'érection (pénis, clitoris, tétons) semble également jouer un rôle important pour la préservation de l'endothélium. Chez une grande proportion d'humains, cette synthèse de NO se révèle insuffisante, augmentant par là même leur risque de présenter une maladie cardio-vasculaire. Ce mécanisme explique l'utilisation des dérivés nitrés comme la trinitrine dans le traitement de ces mêmes maladies cardiaques : Ces médicaments sont transformés en NO, d'une manière non encore totalement élucidée, qui à son tour dilate les artères coronaires, vaisseaux sanguins irriguant le cœur, augmentant son apport sanguin.
L'EDRF (endothelium-derived relaxing factor) est le nom ancien du NO. D'anciens médecins avaient remarqué son rôle vasodilatateur mais ne l'avaient pas encore identifié chimiquement.
Microbicide
Les macrophages, cellules du système immunitaire, produisent du NO dans le but d'éliminer des bactéries pathogènes, NO qui peut, dans certaines circonstances, provoquer des effets secondaires nuisibles : c'est le cas dans les infections fulminantes dites septicémies, où la production excessive de NO par les macrophages conduit à une vaso-dilatation massive, cause principale de l'hypotension artérielle rencontrée dans le choc septique.
Neurotransmetteur
Le NO joue le rôle d'un neurotransmetteur entre cellules nerveuses. À la différence de la majorité des autres neurotransmetteurs, dont l'action dans la fente synaptique a pour cible unique le neurone post-synaptique, la petite molécule de NO diffuse largement et peut atteindre plusieurs neurones environnants, y compris des neurones non inter connectés par des synapses. On pense que ce processus est impliqué dans la mémorisation en assurant la mémorisation à long terme. Les endocannabinoïdes, neurotransmetteurs lipidiques, ont des propriétés de diffusion similaires.
Relaxant des muscles lisses
Le NO est présent dans plusieurs organes du tube digestif comme neuro-transmetteur non-adrénergique, non-cholinergique. Il est responsable de la relaxation des muscles lisses de l'appareil gastro-intestinal. En particulier il accroît la capacité de l'estomac à stocker des liquides alimentaires.
Régulateur de l'apoptose
Le monoxyde d'azote est un régulateur essentiel de l'apoptose cellulaire. Il peut avoir un effet antiapoptotique, ou, inversement, un effet apoptotique[31]. Cette bascule est intimement liée à la présence ou non de réducteurs cellulaires tels de glutathion.
En présence d'un taux élevé d'ion superoxyde O2-, le monoxyde d'azote permet la formation d'ion peroxynitrite[32], probablement responsable de la modification du potentiel de membrane mitochondrial ainsi que de nombreux phénomènes d'apoptose cellulaire, en particulier celle des cellules du système immunitaire[33],[34].
Donneurs exogènes de NO
Utilisations thérapeutiques
Utilisations thérapeutiques[37] :
- Il est utilisé en médecine comme vasodilatateur inhalé. L'utilisation de vasodilatateurs inhalés permet de vasodilater de façon sélective les capillaires des zones pulmonaires bien ventilées. Ceci permet de réduire l'hypertension artérielle pulmonaire liée à la vasoconstriction hypoxique et d'augmenter l'oxygénation du sang.
- Un composé nommé diméthyl-Arginine Asymétrique (ADMA) est un inhibiteur connu de la synthèse de NO, et est donc considéré comme un marqueur biologique de dysfonction cardio-vasculaire.
- La production de NO joue également un rôle important dans l'obtention et la conservation d'une érection durable. Des concentrations accrues de GMPc conduisent à une vaso-dilatation et une érection de meilleure qualité. On pense que l'effet des « poppers » est obtenu également par l'intermédiaire du NO, provoquant une relaxation des fibres musculaires lisses qui entourent les artérioles irriguant les corps caverneux du pénis et augmentent l'afflux sanguin. Le sildénafil (Viagra) et le tadalafil (Cialis), sont des inhibiteurs compétitifs de l'enzyme phosphodiestérase type 5 (PDE5) responsable de l'inactivation du GMP cyclique en GMP.
La découverte des propriétés biologiques du NO dans les années 1980 fut complètement inattendue et provoqua une certaine agitation. Le journal Science nomma le NO « Molécule de l'année » en 1992, une Société savante du NO fut créée et une revue scientifique entièrement consacrée au NO parut. Le Prix Nobel de Médecine et de Physiologie[38] fut remis en 1998 à Ferid Murad, Robert F. Furchgott, et Louis J. Ignarro pour leurs travaux sur les fonctions de neurotransmission du NO. Ces travaux sont à l'origine de la fondation de la société pharmaceutique française Nicox. On estime à 3000 par an la parution d'articles scientifiques sur le rôle en biologie du monoxyde d'azote.
Sécurité
Référence ONU pour le transport de matières dangereuses :
- Nom (français) : Monoxyde d'azote comprimé
- Classe : 2
- numéro : 1660
Bibliographie
- Nathan S Bryan, Janet Zand, Bill Gottlieb, La solution : l’oxyde nitrique (NO), Institut Scientifique et Technique de l’Environnement et de la Santé (ISTES), 2014, 188 pages[39].
Notes et références
- MONOXYDE D'AZOTE, fiche(s) de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée(s) le 9 mai 2009
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- « Properties of Various Gases », sur flexwareinc.com (consulté le 12 avril 2010)
- (en) W. M Haynes, Handbook of chemistry and physics, CRC, 2010-2011, 91e éd., 2610 p. (ISBN 9781439820773), p. 14-40
- (en) Irvin Glassman, Richard A. Yetter, Combustion, Elsevier, , 4e éd., 773 p. (ISBN 978-0-12-088573-2), p. 6
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-4200-9084-0)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- « Monoxyde d'azote » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- « Nitric oxide », sur hazmap.nlm.nih.gov (consulté le 14 novembre 2009)
- Crépel, F., & Lemaire, G. (1995) Le monoxyde d'azote. ; Revue MS (médecine/sciences) ; 11:1639-42 (PDF, 4 pages)
- Gabbai, F. B., Garcia, G. E. et al., Role of nitric oxide in glomerular physiology and pathophysiology, Adv Nephrol Necker Hosp 24, 3-18 (1995)
- R. A. Schroeder et P. C. Kuo, Nitric oxide: physiology and pharmacology, Anesth Analg 81, 1052-9 (1995)
- Enthalpie d'isomérisation de l'ion peroxynitrite en nitrate
- Sennequier, N., & Vadon-Le Goff, S. (1998). Biosynthèse du monoxyde d'azote (NO): mécanisme, régulation et contrôle. MS. Médecine sciences, 14(11), 1185-1195 (http://cat.inist.fr/?aModele=afficheN&cpsidt=1584829 résumé])
- De Soete, G. (1993). Nitrous Oxide from Combustion and Industry: Chemistry, Emissions and Control Protoxyde d'azote provenant de la combustion et de l'industrie: chimie, émissions et techniques de réduction (résumé).
- R.B. King; Inorganic Chemistry of Main Group Elements, VCH Publishers, New York, 1995.
- Química Nova - The chemistry of peroxynitrite, a biological toxin
- Greenwood N.N. & Earnshaw A. (1997). Chemistry of the Elements. 2e Ed. Elsevier, p. 446.
- Skanckea P.N. & Boggsb J. E. (1973). A theoretical study of the structure of (NO)2. Chemical Physics Letters (21) p. 316-317.
- Lipscomb W.N., Wang F.E., May W.R. & Lippert E.L. (1961). Comments on the structures of 1,2-dichloroethane and of N202. Acta.Cryst. (14) p. 1100-01.
- F.A. Cotton, G. Wilkinson, C.A. Murillo, M. Bochmann; Advanced Inorganic Chemistry, 6th ed. Wiley-Interscience, New York, 1999.
- Fischer G & Becknell D ; Anal. Chem., 44, 863, 1972
- Kieselbach, Ind. Eng. Chem., Anal. Ed., 16, 766, 1944
- Pharmacorama ; Monoxyde d'azote
- Nitric oxide synthase is a cytochrome P-450 type h...[Biochemistry. 1992] - PubMed Result
- Andrews, K. L., Triggle, C. R. et al. NO and the vasculature: where does it come from and what does it do? Heart Fail Rev 7, 423-45 (2002)
- Métabolisme du monoxyde d'azote
- Giuliano, F., Rampin, O., Benoit, G., & Jardin, A. (1997). Pharmacologie périphérique de l'érection. Progrès en urologie, 7(1), 24-33.
- Nitric oxide as bifunctional regulator of apoptosis
- The chemistry of peroxynitrites
- Contrasting effects of NO and peroxynitrites on HSP70 expression and apoptosis in human monocytes; Adrie C & al. Am J Physiol Cell Physiol 279:452-460, 2000.
- Functional studies of an HIV-1 encoded glutathione peroxidase
- NO and NO-donors
- Sodium azide as indirect nitric oxide donor: researches on the rat aorta isolated segments ; Ukr Biokhim Zh. 2005 Jul-Aug;77(4):120-3
- Utilisation clinique de l'oxyde nitrique ; Olson G.
- 1998 Prix Nobel de Médecine pour la découverte du rôle de NO dans la régulation cardiovasculaire
- La solution : l’oxyde nitrique (NO), Note de lecture de Louis-Marie Houdebine, pseudo-sciences.org, 31 décembre 2014
Voir aussi
- Syndrome de détresse respiratoire aiguë
- Neurotransmetteur
- EDRF : Endothelium-derived relaxing factor nom donné à cette même molécule avant que l'on connaisse sa formule chimique
- Transduction de signaux
- Mesure des oxydes d'azote
Lien externe
- Nitric Oxide: Biology and Chemistry, journal scientifique
- Portail de la chimie
- Portail de la biochimie
- Portail de la biologie cellulaire et moléculaire
- Portail de la pharmacie
- Portail des neurosciences