Lamivudine
La lamivudine (2',3'-didéoxy-3'-thiacytidine, 3TC) est un puissant inhibiteur nucléosidique de la transcriptase inverse commercialisé sous le nom d'Epivir. Elle peut inhiber les deux types (1 et 2) de transcriptase inverse de VIH ainsi que celle du virus de l'hépatite B. Pour qu'elle devienne active, il faut qu'elle soit phosphorylée sous sa forme triphosphate. Le triphosphate de 3TC inhibe ainsi l'ADN polymérase cellulaire. Elle est actuellement le médicament antirétroviral le plus utilisé, prescrit pratiquement systématiquement, et ceci depuis son introduction dans la trithérapie en 1995-1996, années où la mortalité due au Sida a chuté considérablement.
| Lamivudine | |
 | |
| Identification | |
|---|---|
| Nom UICPA | (2R,5S)-(–)-4-amino-1-[2-(hydroxyméthyl)-1,3 -oxathiolan-5-yl]-1H-pyrimidin-2-one |
| Synonymes |
3TC |
| No CAS | (2R,5S) (–) |
| No ECHA | 100.132.250 |
| Code ATC | J05 |
| DrugBank | DB00709 |
| PubChem | 60825 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule brute | C8H11N3O3S [Isomères] |
| Masse molaire[1] | 229,256 ± 0,014 g/mol C 41,91 %, H 4,84 %, N 18,33 %, O 20,94 %, S 13,99 %, |
| Données pharmacocinétiques | |
| Biodisponibilité | 86 % |
| Liaison protéique | inférieure à 36 % |
| Métabolisme | Rénal (environ 70 % recouvré inchangé. Le principal métabolite est la S-oxythiacytidine) |
| Demi-vie d’élim. | 5 à 7 h |
| Excrétion | |
| Considérations thérapeutiques | |
| Voie d’administration | Orale, IV |
| Unités du SI et CNTP, sauf indication contraire. | |
La lamivudine est administrée par voie orale, et elle est rapidement absorbée avec une biodisponibilité supérieure à 80 %. Diverses recherches tendent à montrer que la lamivudine peut passer la barrière hémato-encéphalique. Elle est souvent utilisée en combinaison avec la zidovudine. Ces deux antirétroviraux agissent de manière synergétique. Il a été montré que le traitement par la lamivudine restaure la sensibilité à la zidovudine chez les personnes devenues résistantes au VIH.
Une mutation (M184V) du VIH lui permet d’acquérir une résistance à la lamivudine. Toutefois, de façon générale, il est conseillé de poursuivre le traitement au 3TC même si cela se produit, cette mutation semble produire un virus se répliquant moins efficacement et restant encore contrôlé par la lamivudine. En effet, la mutation en question rend la polymérase virale plus affine pour l'ADN (baisse de la processivité), ce qui ralentit la réplication et donc diminue la charge virale. De plus, elle rend également la polymérase plus fidèle, évitant ainsi une accumulation d'autres mutations. Par exemple, des études ont montré qu'une monothérapie de 3TC permet une meilleure évolution clinique et immunologique qu'un arrêt thérapeutique chez les patients séropositifs précédemment sous trithérapie dont le virus était devenu résistant à la lamivudine[2]. Dans le cas d'une trithérapie, sans autre mutation constatée, le virus muté reste sensible à d'autres molécules. De nombreux tests de mutagénicité montrent que la lamivudine ne présente pas d'activité mutagène aux doses thérapeutiques.
La lamivudine a été utilisée pour le traitement de l'hépatite B chronique à une dose plus faible que l'utilisation pour le traitement de l'infection à VIH. Il améliore la séroconversion de l'antigène e positif de l'hépatite B, et aussi la mise en scène histologie du foie. Une utilisation à long terme de la lamivudine conduit au développement d'un virus résistant de l'hépatite B (YMDD) par mutation. Malgré cela, la lamivudine est encore largement utilisée tant elle est bien tolérée.
Elle fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en avril 2013)[3].
Le médicament est en cours de test contre le virus Ebola[4].
Historique
La lamivudine, initialement appelée BCH-189 puis 3TC, a été conçue par le Dr. Bernard Belleau et synthétisée la première fois en 1989 par le Dr. Nghe Nguyen-Ba. Tous deux travaillaient alors pour la société québécoise BioChem Pharma. Le chercheur canadien Mark Wainberg, avec d'autres chercheurs, confirme son activité antivirale contre le HIV-1 in vitro[5].
Les travaux de l'équipe du médecin-chercheur Lorne Tyrrell de l'Université de l'Alberta, Canada, ont montré que la lamivudine était aussi un traitement efficace contre l'hépatite B[6].
La synthèse de novo est réalisée en milieu totalement anhydre, à cause de la sensibilité de l'acétal soufré formé aux acides aqueux. Celle-ci peut être résumée par le schéma suivant[7] :
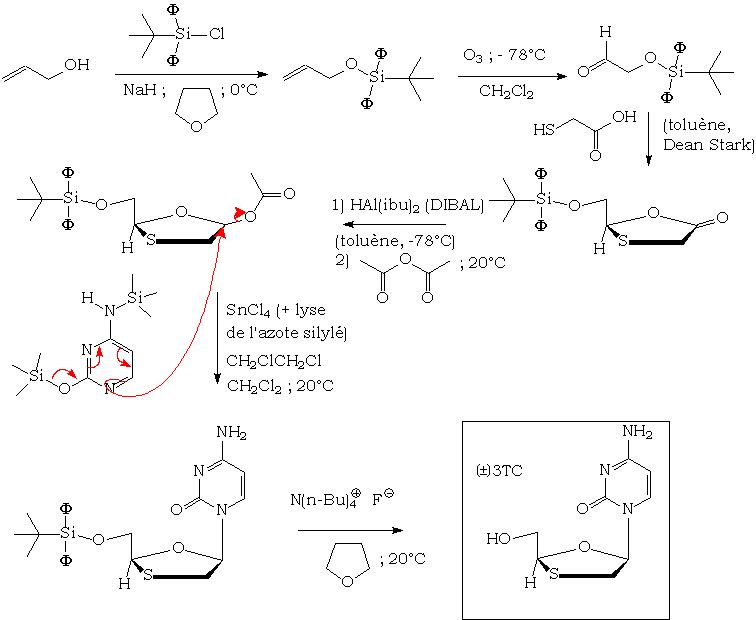
Prospectives
Le Dr Gobee Logan l'a utilisée contre Ebola, en désespoir de cause, avec succès (à confirmer en respectant le protocole), considérant les modes d'action similaires de ces deux virus[8],[9],[10].
Liens externes
- Compendium suisse des médicaments : spécialités contenant Lamivudine
- Page spécifique sur Le Vidal.fr
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Lamivudine monotherapy in HIV-1-infected patients harbouring a lamivudine-resistant virus: a randomized pilot study (E-184V study).
- WHO Model List of Essential Medicines, 18th list, avril 2013
- , septembre 2014
- Yanick Villedieu, « Mark Wainberg et la lutte au VIH », Radio-Canada.ca, (lire en ligne)
- Découverte de Lorne Tyrrell
- Method and compositions for the synthesis of BCH-189
- Jean-Yves Nau, « Ebola: un médecin a testé avec succès un médicament contre le Sida », sur slate, (consulté le 4 septembre 2016)
- https://www.sciencesetavenir.fr/sante/20140930.OBS0677/ebola-un-traitement-contre-le-sida-efficace.html
- « Ebola : des patients survivent grâce à un traitement contre le Sida », sur pourquoidocteur.fr, (consulté le 4 septembre 2016)
- Portail de la médecine
- Portail de la virologie
- Portail de la pharmacie
- Portail de la chimie