Hexachlorophène
L'hexachlorophène est un puissant bactéricide créé par la société Givaudan.
| Hexachlorophène | |||
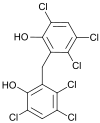 | |||
| Identification | |||
|---|---|---|---|
| Synonymes |
2,2'-méthylène-bis(3,4,6-trichlorophénol) |
||
| No CAS | |||
| No ECHA | 100.000.667 | ||
| No EC | 200-733-8 | ||
| Code ATC | D08 | ||
| SMILES | |||
| InChI | |||
| Apparence | sans odeur, poudre cristalline blanche[1] | ||
| Propriétés chimiques | |||
| Formule brute | C13H6Cl6O2 [Isomères] |
||
| Masse molaire[2] | 406,904 ± 0,023 g/mol C 38,37 %, H 1,49 %, Cl 52,28 %, O 7,86 %, |
||
| pKa | 4,95 | ||
| Propriétés physiques | |||
| T° fusion | 166,5 °C[3] | ||
| T° ébullition | 479 °C[3] | ||
| Solubilité | 140 mg·L-1 (eau, 25 °C)[3] | ||
| Précautions | |||
| SGH[4] | |||
  Danger |
|||
| SIMDUT[5] | |||
Produit non classifié |
|||
| Transport | |||
| Classification du CIRC | |||
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[6] | |||
| Écotoxicologie | |||
| DL50 | 67 mg·kg-1 (souris, oral) 7,5 mg·kg-1 (rat, i.v.) 46 mg·kg-1 (souris, s.c.) 20 mg·kg-1 (souris, i.p.)[3] |
||
| LogP | 7,54 (calculé)[1] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
Utilisation
Son utilisation dans le talc pour bébés fut longtemps considérée comme bénigne jusqu'à l'éclatement de l'affaire du talc Morhange. En 1971, une affaire semblable avait déjà eu lieu aux États-Unis où l'hexachlorophène était utilisé depuis des années comme désinfectant en solution à 3 % pour la toilette des nourrissons.
L'étude de la toxicité de ce produit a été réduite à sa plus simple expression, et semble n'avoir jamais été complètement publiée[7].
L'étude semble se limiter à soumettre le produit à une dizaine de cochons d'Inde en l'incorporant à l'alimentation. Tous sont morts dans les trois premiers jours de l'expérimentation. En 1939, étant pressés par le temps, les laboratoires ont conservé confidentiellement ces résultats inquiétants.
À cette époque, aucun contrôle n'était imposé sur les produits cosmétiques.
L'hexachlorophène était aussi présent dans les rayures rouges du dentifrice Signal dont la publicité était « Ses rayures rouges contiennent de l'hexachlorophène pour nettoyer et protéger les dents ». À la suite de l'affaire du talc Morhange, ce slogan a disparu.
L'hexachlorophène apportait à ses producteurs le double avantage d'être vendu en tant que produit cosmétique plus dispendieux et d'être vendu en tant que médicament.
L'hexachlorophène a demeuré longtemps commercialisé industriellement sous le nom de « G11 », le cachant ainsi des scientifiques.
Articles connexes
- Toxicologie
- Éthique médicale
- Affaire du talc Morhange
Notes et références
- HEXACHLOROPHENE, fiche(s) de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée(s) le 9 mai 2009
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Hexachlorophene » sur ChemIDplus, consulté le 6 février 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008 (16 décembre 2008)
- « Hexachloro-2,2′,3,3′,5,5′-dihydroxy-6,6′-diphénylméthane » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Évaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme », sur http://monographs.iarc.fr, CIRC, (consulté le 22 août 2009)
- Jean D. Lockhart M.D, 1972, HOW TOXIC IS HEXACHLOROPHENE?, Pediatrics, vol. 50, no 2, août 1972, p. 229-235, (lien
- Portail de la chimie
- Portail de la médecine