Fluorure de potassium
Le fluorure de potassium est un composé inorganique de formule KF. Après le fluorure d'hydrogène, il est la principale source d'ion fluorure utilisée dans l'industrie et en chimie. C'est un halogénure de métal alcalin (en) présent naturellement sous la forme d'un minéral rare, la carobbiite (en). Les solutions de KF peuvent attaquer le verre, du fait de la formation de fluorosilicates solubles, même si l'acide fluorhydrique est plus efficace pour cette tâche.
| Fluorure de potassium | |||
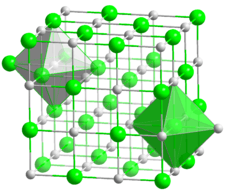 | |||
| Structure cristalline du fluorure de potassium. __ K+ __ F- |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | fluorure de potassium | ||
| No CAS | (anhydre) (dihydrate) |
||
| No ECHA | 100.029.228 | ||
| No EC | 232-151-5 | ||
| No RTECS | TT0700000 | ||
| PubChem | 522689 | ||
| SMILES | |||
| InChI | |||
| Apparence | poudre ou cristaux, blancs parfois verdâtres, inodores[1] | ||
| Propriétés chimiques | |||
| Formule brute | KF | ||
| Masse molaire[2] | 58,0967 ± 0,0001 g/mol F 32,7 %, K 67,3 %, |
||
| Moment dipolaire | 8,585 ± 0,003 D[3] | ||
| Propriétés physiques | |||
| T° fusion | 858 °C[1] | ||
| T° ébullition | 1 502 °C[1] | ||
| Solubilité | 485 g·l-1 (eau, 20 °C)[1] | ||
| Masse volumique | 2,48 g·cm-3[1] | ||
| Cristallographie | |||
| Structure type | NaCl[4] | ||
| Précautions | |||
| SGH[5] | |||
 Danger |
|||
| SIMDUT[6] | |||
 D1B, D2A, |
|||
| Transport[1] | |||
| Écotoxicologie | |||
| DL50 | 245 mg kg−1 (rat, oral)[7] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
Propriétés
Le fluorure de potassium se présente sous la forme d'une poudre blanche hygroscopique, généralement sous sa forme dihydrate. Le dihydrate fond à 46 °C dans son eau de cristallisation. On peut dissoudre 485 g de fluorure de potassium dans un litre d'eau à 20 °C.
Le fluorure de potassium a une enthalpie standard de formation de ΔHf°= -569 kJ/mol[8]
Du fait que le potassium naturel contient 0,0118 % du radioisotope 40K, la radioactivité de KF est de 20 979 Bq kg−1, à 89,28 % du rayonnement bêta et à et 10,72 % rayonnement gamma de 1,460 83 MeV.
Synthèse
Le fluorure de potassium peut être préparé par dissolution carbonate de potassium en excès dans l'acide fluorhydrique. Lors de l'évaporation de la solution, il se forme des cristaux de bifluorure de potassium. En chauffant ce bifluorure on obtient le fluorure de potassium :
Ce sel ne peut évidemment pas être préparé dans un récipient en verre ou en porcelaine car il serait attaqué par l'acide flurohydrique. Un récipient en plastique (PTFE) résistant à la chaleur ou en platine doit être utilisé.
Applications
Chimie
En chimie organique, le fluorure de potassium peut être utilisé pour la conversion de composés organochlorés en composés organofluorés, via la réaction de Finkelstein[9]. Pour de telles réactions on utilise en général un solvant polaire tel que le diméthylformamide (DMF), l'éthylène glycol ou le diméthylsulfoxyde (DMSO)[10].
Autres
Le fluorure de potassium est utilisé dans la production d'émail, comme additif pour ciment, comme oxydant dans la poudre de soudure d'aluminium. Il est aussi utilisé comme agent de conservation du bois et pour la gravure sur verre. Il peut aussi être utilisé comme source d'ions fluorures dans les produits d'hygiène buccale (dentifrice, bain de bouche, etc.) et pour des aliments fluorés (sel alimentaire, eau).
Précautions
Comme d'autres source d'ions fluorures, KF est toxique, même si les doses létales sont du niveau du gramme pour l'homme. Il est dangereux par inhalation et ingestion. Il est hautement corrosif, tout contact avec la peau pouvant résulter en de sévères brûlures.
Notes et références
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Potassium fluoride » (voir la liste des auteurs) et en allemand « Kaliumfluorid » (voir la liste des auteurs).
- Entrée de « Potassium fluoride » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 22 octobre 2015 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- (en) Bodie E. Douglas, Shih-Ming Ho, Structure and Chemistry of Crystalline Solids, Pittsburgh, PA, USA, Springer Science + Business Media, Inc., , 346 p. (ISBN 0-387-26147-8), p. 64
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Fluorure de potassium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- )U.S. Atomic Energy Commission, University of Rochester, Research and Development Reports. Vol. UR-154, Pg. 1951
- (de) A. F. Holleman, E. Wiberg, N. Wiberg, Lehrbuch der Anorganischen Chemie, Berlin, de Gruyter, (ISBN 3-11-012641-9), p. 1170
- Vogel, A. I.; Leicester, J.; Macey, W. A. T.. "n-Hexyl Fluoride". Org. Synth.; Coll. Vol. 4: 525.
- Han, Q.; Li, H-Y. "Potassium Fluoride" in Encyclopedia of Reagents for Organic Synthesis, 2001 John Wiley & Sons,New York. DOI:10.1002/047084289X.rp214
- Portail de la chimie
