Fièvre récurrente mondiale
La fièvre récurrente mondiale dite aussi cosmopolite est une maladie infectieuse due à Borrelia recurrentis transmise par le pou de corps. Elle se manifeste par des accès périodiques (récurrences) de fièvre durant 3 à 6 jours, séparés par des intervalles libres (rémissions) de plusieurs jours.
Autrefois cosmopolite, cette maladie épidémique est devenue plus rare depuis le milieu du XXe siècle. On la trouve encore en Afrique de l'Est, et elle peut ressurgir dans toute population en hygiène précaire (présence de poux de corps).
Les fièvres récurrentes régionales dites aussi tropicales sont dues à d'autres Borrelia réparties selon des zones géographiques particulières (Espagne et Afrique du Nord, Afrique de l'Ouest, États-Unis...). Elles sont transmises par des tiques molles (Argasidae) du genre ornithodore. De caractère endémique ou sporadique, elles se présentent comme des fièvres intermittentes, à récurrences plus nombreuses et moins régulières que la fièvre récurrente mondiale.
La gravité des fièvres récurrentes infectieuses est variable, dépendant des zones géographiques et de l'état préalable du sujet infecté. Le diagnostic est essentiellement clinique. Le traitement antibiotique est efficace, faisant passer la mortalité des formes graves de 40 % à moins de 5 %.
Histoire
Des mentions éventuelles de fièvres récurrentes existeraient chez Hippocrate (Épidémies, I et III) notamment lorsqu'il décrit la constitution épidémique de l'île de Thasos[1]. Il est possible aussi que le terme « fièvre jaune » utilisé en Europe au XVIIe siècle, recouvre une forme hépato-biliaire de fièvre récurrente. De même parmi les maladies pouvant expliquer les épidémies de suette anglaise en 1485-1551, la fièvre récurrente à poux est un candidat possible[2].
Ce type de fièvre est observé dans l'armée française durant la campagne d'Égypte (1798-1799), sous le nom de « fièvres à rechutes » par Larrey.
Épidémies historiques
La première description valable de fièvre récurrente est faite par un médecin de Dublin, John Rutty (en), en 1739. Souvent confondue avec le typhus, sous le terme de « typhus récurrent », la maladie s'observe par des épidémies successives en Grande-Bretagne (1841), durant la grande famine d'Irlande (1846-1850), en Prusse (1846-1848), en Russie (1864-1865), en Finlande (1876-1877)[2] provoquant la mort de 2 à 40 % des patients infectés[3].
La fièvre récurrente est introduite aux États-Unis par les immigrants irlandais avec des épidémies à Philadelphie (1844 et 1869) et New-York (1847-1871).
Durant la première guerre mondiale, l'Europe centrale et la Russie subissent de grandes épidémies. Au cours du XXe siècle, on distingue un foyer endémique chinois, le long du fleuve Yangtsé dans les années 1930. Son apparition en Corée à la fin de la guerre de Corée indiquerait que ce foyer chinois persiste[2].
Dans la deuxième moitié du XXe siècle, les foyers majeurs se situent en Afrique (Afrique du Nord proprement dite et Afrique tropicale nord), plus particulièrement en Éthiopie (2 000 à 10 000 cas annuels en 1970-1980) et surtout au Soudan avec 22 000 à 50 000 cas (1978-1981). Toutefois ces derniers chiffres sont discutés, car ce signalement inclurait des cas de typhus et de paludisme, et la crainte d'une escalade épidémique à cette époque s'est révélée infondée. Toutefois la fièvre récurrente reste bien présente sur un fond endémique[2].
Aux États-Unis, de petites épidémies peuvent encore survenir chez des personnes passant la nuit dans des cabanes en bois, infestées de tiques, en zone forestière : 11 cas parmi des scouts dans les Appalaches en 1968, et 62 cas parmi des touristes de la rive nord du Grand Canyon en 1973[2].
Données bio-médicales
Le terme de « relapsing fever » en anglais (fièvre récurrente en français) est utilisé pour la première fois par David Craigie (en), médecin d'Édimbourg en 1843. La fièvre récurrente à poux est distinguée du typhus et de la typhoïde (de façon clinique) par William Jenner en 1849[2].
En 1867, lors d'une épidémie à Berlin, Otto Obermeier (de) observe dans le sang de malades un micro-organisme spiralé, d'abord appelé Spirocheta obermeieri, qui sera renommé Borrelia recurrentis. C'est le premier micro-organisme pathogène identifié chez l'homme, mais cette observation ne sera publiée qu'en 1873.
Le rôle du pou de corps comme vecteur est découvert par un médecin britannique aux Indes, F.P. Mackie en 1907.
L'épidémiologie des fièvres récurrentes à poux, et son cycle complet, est établie par des chercheurs de l'Institut Pasteur d'Alger : Charles Vialatte, Henry Foley et Edmond Sergent durant les années 1923 - 1925 ; et précisée par Charles Nicolle et ses collaborateurs à l'Institut Pasteur de Tunis jusqu'en 1932[2].
Épidémiologie
La fièvre récurrente à poux est devenue rare au début du XXIe siècle. Autrefois cosmopolite, elle semble ne plus sévir, de manière endémique ou lors d'épidémies, que dans des foyers localisés en Afrique de l'Est (Éthiopie, Soudan et Rwanda[3]) ainsi que dans certaines zones des contreforts de la Cordillère des Andes, populations rurales en Russie, ou précaires des pays développés[4].
Cependant, de nouvelles épidémies y compris en réémergence ne sont pas impossibles, dans des contextes de famine, guerres, catastrophes naturelles pouvant favoriser un manque d'hygiène[5].
En 2015, 3 cas ont été signalés chez des réfugiés en Sicile, provenant de l'Érythrée[6], et 15 cas chez des réfugiés en Bavière, provenant de la Corne de l'Afrique[7].
Les fièvres récurrentes à tiques (tique molle du genre Ornithodoros) sont endémiques dans de nombreuses régions du monde, touchant surtout les populations rurales exposées aux tiques[8]. Elles sont rares en France, mais on peut les trouver en Espagne, aux États-Unis ou en Afrique de l'Ouest, notamment au Sénégal[9].
Agent causal
Fièvre récurrente mondiale
Son agent pathogène est une bactérie spirochète appartenant au genre borrelia : Borrelia recurrentis. Elle est restée jusque dans les années 1980 mal connue, car on ne savait pas la cultiver, ce qui a freiné sa caractérisation. Puis on a réussi, au début des années 1990 à les cultiver[10], ce qui a permis de rapidement caractériser des dizaines de souches provenant de patients atteints de fièvre récurrente à poux.
La microscopie électronique montre des cellules spirochétales (spiralées) aux extrémités pointues, d'une longueur d'onde moyenne de 1,8 pm, d'amplitude de 0,8 pm et à 8 à 10 flagelles périplasmiques. Le ratio G+C était de 28,4 Mole%[3].
Les tests d'hybridation d'ADN faits au début des années 1990 ont montré une forte similitude entre les isolats de 18 souches cultivées de B. recurrentis mais non avec d'autres borrélies telles que Borrelia hermsii, Borrelia parkeri ou Borrelia turicatae, ni avec les borrélies associées à la maladie de Lyme[3].
Les premiers séquencages génétiques des gènes codant la flagelline (utilisés pour l'étude des borrélies, dont de la maladie de Lyme[11]) et de l'ARN 16S ont révélé la proximité la plus grande avec Borrelia duttonii[3].
Des sous-groupes semblent exister ; l'analyse des profils d'électrophorèse sur gel a révélé quatre groupes distincts en fonction de la position d'une bande protéique majeure. L’électrophorèse en champ pulsé a révélé cinq modèles distincts.
Fièvres récurrentes régionales
Elles sont dues à de multiples espèces de Borrelia, au moins une quinzaine, ce sont les fièvres récurrentes à tiques. Elles sévissent sous forme sporadique ou endémique. Les principales sont :
Ancien Monde (Afrique et Moyen-Orient)
- B. hispanica : fièvre récurrente espagnole ou hispano-marocaine, transmis par la tique Ornithodoros erraticus et O. marocanus.
- B. persica : fièvre récurrente asiatique, ou de Perse, transmis par O. tholozani.
- B. duttoni : fièvre à tiques africaine ou fièvre récurrente africaine (Afrique centrale, de l'Est et du Sud), transmis par O. moubata.
- B. crocidurae : fièvre récurrente de Dakar, en Afrique de l'Ouest et du Nord, transmis par O. sonraï.
Nouveau Monde
- B. turicatae : fièvre récurrente sporadique des États-Unis, ou fièvre récurrente du Texas, transmis par O. turicatæ.
- B. hermsii : fièvre récurrente canadienne, se trouve aussi dans l'ouest des États-Unis, transmis par O. hermsi.
- B. venezuelensis : fièvre récurrente d'Amérique du Sud, transmis par O. venezuelensis.
Transmission
B. recurrentis (fièvre récurrente cosmopolite) est transmis à l'être humain par les poux du corps (le rôle des poux de tête est discuté et non démontré), et les autres Borrelia (fièvres récurrentes régionales) par les tiques molles Ornithodores. La transmission par le pou se fait par écrasement et par les tiques par piqûres.
Pou
Le pou se contamine en piquant un malade en phase fébrile. L'homme est le seul réservoir connu[4]. Les Borrelia qu'il a ingéré se multiplient dans la cavité générale du pou, dans l'hémocœle contenant l'hémolymphe. La piqûre et les déjections du pou ne sont pas contaminantes.
La contamination se fait au niveau d'excoriations cutanées (peau écorchée) ou au niveau conjonctival lors de l'écrasement d'un pou, l'opération libérant le liquide cœlomique, riche en Borrelia.
On ignore comment B. recurrentis peut persister ou survivre entre les épidémies[12].
Tiques
Les tiques molles constituent le réservoir des autres Borrelia provoquant des fièvres récurrentes. Elles restent contaminées toute leur vie et transmettent l'infection à leur descendance (transmission trans-ovarienne). En tant que vecteurs, elles transmettent l'infection à des mammifères (rongeurs, animaux domestiques...) et à l'homme au moment de la piqûre, plus rarement par leurs déjections[8].
Les tiques dures comme Ixodes peuvent transmettre différentes espèces de Borrelia comme B. miyamotoi, B. lonestari, B. theileri, susceptibles de donner des fièvres récurrentes, mais ceci reste encore mal connu et du domaine de la recherche[13].
Pathogénie
Les périodes fébriles correspondent à la dissémination des bactéries dans le sang ou bactériémies (passage ou présence sans multiplication). Les bactéries sont éliminées du sang, mais elles peuvent survivre en résistant à l'opsonisation.
Les rémissions ou périodes d'apyrexie correspondent aux phases de « séquestration » de la bactérie dans les organes profonds. Comme les autres borrélies, cette bactérie dispose de stratégies, comme la transcytose (passage à travers des cellules intactes) pour déjouer les barrières anatomiques, ou la « variation antigénique » (modification de structure de ses protéines de surface) pour contourner le système immunitaire humain (inné et adaptatif)[14],[15].
Les périodes de rechute fébrile sont liées à l'émergence de nouveaux variants qui échappent aux premiers anticorps, et repassent alors dans le sang[15].
Dans la fièvre récurrente mondiale à poux, il existe le plus souvent deux récurrences régulières, dans les fièvres récurrentes à tiques les récurrences sont plus nombreuses et moins régulières.
Clinique
La période d'incubation dure en moyenne de 2 à 8 jours. Le tableau qui suit est la forme classique (fièvre récurrente mondiale, à poux, par B. recurrentis), telle qu'on la décrivait avant l'ère des antibiotiques[16].
Début
Le plus souvent, le début est extrêmement brutal avec frissons suivis aussitôt d'une fièvre qui grimpe rapidement à 40−41 °C, avec algies diffuses. Le début peut être si soudain que le patient « frappé en plein travail, se couche là où il se trouve ».
L'examen montre une congestion de la face, et une injection (dilatation des vaisseaux) des conjonctives. Le pouls est rapide, en rapport avec la température ; la respiration est accélérée et superficielle.
État
La fièvre récurrente à poux donne une courbe thermique très régulière. La première période fébrile dure une semaine avec fièvre en plateau à 40 °C avec de légères rémissions matinales.
Les algies, surtout des maux de tête, persistent. Le faciès reste congestif mais la langue a gardé sa mobilité ; elle est humide et « soufrée ». Il existe une hépatomégalie et une splénomégalie, molles, en « éponge ». On peut observer un léger exanthème ou des pétéchies, localisé au cou, au tronc et aux membres supérieurs.
Une bronchite est présente dans 40 à 60 % des cas, et un ictère franc dans 20 à 60 % des cas[2].
Il existe parfois un syndrome méningé typique : le malade est couché en chien de fusil, tourné vers le mur à cause d'une photophobie, maux de tête violents, vomissements... Malgré cet abattement, il n'y a jamais de tuphos (distinction avec le typhus et la fièvre typhoïde).
Après 5 à 7 jours, la fièvre tombe brutalement vers 37 °C, selon une crise d'une heure ou deux, faite d'une débâcle urinaire, sudorale et diarrhéique qui vient clore ce premier épisode fébrile.
Dans la semaine qui suit (de 5 à 10 jours), la température est normale, les autres signes ont disparu à l'exception d'une fatigue, et de quelques douleurs.
Récurrences
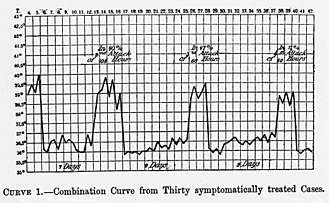
Après cette période de rémission, c'est-à-dire en moyenne le 14e jour (7-20 jours) après le début de la maladie, la récurrence (rechute) surgit. Le tableau clinique est pratiquement celui de la première crise.
L'évolution peut se faire alors selon diverses modalités :
- défervescence définitive aboutissant à la guérison spontanée (en une ou deux récurrences).
- nouvelle rémission, suivie de plusieurs récurrences qui se succèdent, de plus en plus brèves, et de plus en plus atténuées.
- apparition de complications hépatiques, neurologiques, oculaires et uro-génitales entraînant une mortalité de 5 %, 10 % et parfois même 50 %.
Ce pronostic est, de nos jours, complètement transformé par l'antibiothérapie très efficace contre Borrelia recurrentis.
Diagnostic
Le diagnostic est clinique mais n'apporte que des éléments de présomptions.
On éliminera :
- un accès de malaria à Plasmodium falciparum qui s'accompagne d'une rate dure et d'une courbe thermique bien différente,
- un typhus dont on ne retrouve ni l'exanthème important ni le tuphos et qui ne donne pas de grosse rate,
- une fièvre jaune à laquelle on pensera dans les formes à ictère marqué,
- une leptospirose mais sa fièvre est très anarchique et elle entraîne toujours une forte hépatomégalie.
Depuis l'avènement des antibiotiques, on peut se trouver devant une fièvre d'allure intermittente mais moins caractéristique, à la suite d'une prise en charge inadaptée. Le problème rejoint alors celui des fièvres prolongées ou persistantes (définies comme durant plus de 21 jours)[9].
La prise de sang en période fébrile montre neutrophilie, anémie et cytolyse hépatique. Le diagnostic est alors certain si la bactérie est vue au microscope à fond noir dans le sang frais, ou après coloration à l'encre de Chine ou autres colorations. La découverte de Borrelia dans le liquide cérébro-spinal ou les urines est plus rare[8].
Des tests PCR mixtes pour détecter à la fois le typhus ou la fièvre récurrente à pou ont été mis au point[17] .
Complications et pronostic
Les complications peuvent être neurologiques (méningite lymphocytaire, paralysie des nerfs crâniens, hémiplégie, paraplégie...) ou psychiques (agitation, confusion, hallucination, délire...) ; oculaires, cardiaques ou hémorragiques.
Les formes les plus graves sont les complications hépatiques et rénales (hépatonéphrite), associant une double défaillance du foie et des reins, rare mais mortelle.
La gravité varie selon le terrain : chez l'enfant la maladie est en principe moins grave que chez l'adulte. Chez la femme enceinte les avortements spontanés sont fréquents. Chez les personnes âgées, les déshydratés et les dénutris la maladie est beaucoup plus grave.
La gravité (fréquence des complications neurologiques) varie aussi selon les régions, elle est la plus forte en Afrique centrale et de l'Est (par B. duttoni), relativement bénigne en Afrique de l'Ouest (par B. crocidurae) et du Nord[16]. De même la fièvre récurrente asiatique ou de Perse (par B. persica) est plus grave que l'hispano-marocaine (B. hispanica), et la nord-américaine (par B. turicatæ) que la sud-américaine (par B. venezuelensis)[13].
La fièvre récurrente à tique peut être masquée en s'associant à d'autres infections, notamment au paludisme en Afrique Noire. Le diagnostic et le traitement peuvent être retardés favorisant la survenue de complications tardives.
Sans traitement, la mortalité peut atteindre 40 % (30 à 70 % selon les contextes et sources).
Traitement
L'antibiothérapie a permis de réduire la mortalité des formes graves de 40 % à moins de 5 % : tétracycline, érythromycine ou béta-lactamine ou macrolide, durant 5 à 10 jours. Pour les cyclines, des auteurs ont montré qu'une prise unique pouvait être efficace[8].
Au début du traitement, une réaction de Jarisch-Herxheimer peut survenir[18]. Le traitement n'empêche pas toujours les complications oculaires : iridocyclite, névrite optique, surtout avec B. duttoni .
Prévention et surveillance
La quarantaine d'autrefois n'est plus de rigueur. Cependant, il faut isoler le patient pendant la 1re semaine et l'épouiller par savonnage et insecticide sur le corps et les vêtements.
Les mesures collectives de prévention sont difficiles sur le terrain (destruction ou contrôle des rongeurs et de leurs parasites vecteurs). En pratique, on conseille les mesures de protection individuelle contre les vecteurs et le nettoyage de l'habitat[8],[16] à l'aide d'insecticides[14].
Voir aussi
Articles connexes
- Fièvre récurrente
- Borréliose
- Maladie de Lyme
- Maladies vectorielles à tiques
Liens externes
- (en) CDC: Relapsing Fever
Bibliographie
- (en) SJ Cutler, J Moss, M Fukunaga, D. J. M. Wright, D. Fekade et D. Warrel, Borrelia recurrentis characterization and comparison with relapsing-fever, Lyme-associated, and other Borrelia spp. ; International journal of systematic bacteriology, 1997, Vol. 47, No. 4, p. 958-968, International Union of Microbiological Societies, 0020-7713/97.
Références
- Mirko D. Grmek, Les maladies à l'aube de la civilisation occidentale, Payot, coll. « Médecine et sociétés », (ISBN 2-228-55030-2), p. 418-419.
- (en) Anne Hardy, Relapsing fever, Cambridge University Press, (ISBN 0-521-33286-9), p. 967-970dans The Cambridge World History of Human Disease, K.F. Kiple (dir.).
- SJ Cutler, J Moss, M Fukunaga, D. J. M. Wright, D. Fekade et D. Warrel, Borrelia recurrentis characterization and comparison with relapsing-fever, Lyme-associated, and other Borrelia spp. ; International journal of systematic bacteriology, 1997, Vol. 47, No. 4, p. 958-968, International Union of Microbiological Societies, 0020-7713/97/$04.00
- (en) S. Badiaga, « Human louse-transmitted infectious diseases », Clinical Microbiology and infection, (lire en ligne)
- Raoult D, Roux V (1999) The body louse as a vector of reemerging human diseases. Clin Infect Dis 29: 888–911 (résumé, en anglais).
- (en-US) Alessandra Ciervo, Fabiola Mancini, Francesca di Bernardo et Anna Giammanco, « Louseborne Relapsing Fever in Young Migrants, Sicily, Italy, July–September 2015 », Emerging Infectious Diseases, vol. 22, no 1, , p. 152–153 (ISSN 1080-6040 et 1080-6059, DOI 10.3201/eid2201.151580, lire en ligne)
- (en) Martin Hoch, Andreas Wieser, Thomas Löscher et Gabriele Margos, « Louse-borne relapsing fever (Borrelia recurrentis) diagnosed in 15 refugees from northeast Africa: epidemiology and preventive control measures, Bavaria, Germany, July to October 2015 », Eurosurveillance, vol. 20, no 42, (ISSN 1025-496X et 1560-7917, DOI 10.2807/1560-7917.es.2015.20.42.30046, lire en ligne)
- E. Pilly, Maladies Infectieuses et Tropicales, Alinea Plus, (ISBN 978-2-916641-66-9), p. 380-381.
- Vincent Le Moing, « Fièvres intermittentes d'origine infectieuse », La Revue du Praticien, vol. 52, no 2, , p. 139-144.
- Cutler, S. J., D. Fekade, K. Hussein, K. A. Knox, A. Melka, K. Cann, A. R. Emilianus, D. A. Warrell, and D. J. M. Wright. 1994. Successful in-vitro cultivation of Borrelia recurrentis. Lancet 343:242. (Letter.)
- Fukunaga, M., K. Okada, M. Nakao, T. Konishi, and Y. Sato. 1996. Phylogeny of Borrelia species based on flagellin gene sequences and its application for molecular typing of Lyme disease borreliae. Int. J. Syst. Bacteriol. 46:898-905
- Marc Gentelini, Médecine Tropicale, Flammarion, (ISBN 2-257-14394-9), p. 349-353.
- Emilie Talagrand-Reboul, Pierre H. Boyer, Sven Bergström et Laurence Vial, « Relapsing Fevers: Neglected Tick-Borne Diseases », Frontiers in Cellular and Infection Microbiology, vol. 8, (ISSN 2235-2988, PMID 29670860, PMCID PMC5893795, DOI 10.3389/fcimb.2018.00098, lire en ligne)
- Fritz H. Kayser, Manuel de poche de microbiologie médicale, Flammarion Médecine-Sciences, (ISBN 978-2-2571-1335-1), p. 340-342.
- Grosskinsky S, Schott M, Brenner C, Cutler SJ, Kraiczy P, et al. (2009) Borrelia recurrentis Employs a Novel Multifunctional Surface Protein with Anti-Complement, Anti-Opsonic and Invasive Potential to Escape Innate Immunity. PLoS ONE 4(3): e4858. doi:10.1371/journal.pone.0004858
- P. Aubry, « Fièvres récurrentes », Encyclopédie Médico-Chirurgicale - maladies infectieuses et paraistaires, , p. 13-16fascicule 8999
- J.U. Jiang, Joseph J. Temenak, Allen L. Richards, Real-Time PCR Duplex Assay for Rickettsia prowazekii and Borrelia recurrentis ; online: 24 JAN 2006 DOI: 10.1111/j.1749-6632.2003.tb07380.x Issue Annals of the New York Academy of Sciences Annals of the New York Academy of Sciences Volume 990, RICKETTSIOLOGY: Present and Future Directions pages 302–310, June 2003 ; (Résumé, en anglais)
- Thomas Butler, Paul K. Jones et Craig K. Wallace, Borrelia recurrentis Infection: Single-Dose Antibiotic Regimens and Management of the Jarisch-Herxheimer Reaction ; Oxford Journals Medicine ; Journal of Infectious Diseases ; Volume137, Issue5 ;Pp. 573-577 (résumé
- Portail de la médecine