Chlorure d'acétyle
Le chlorure d'acétyle ou chlorure d'éthanoyle est un composé organique du groupe des chlorures d'acyle, une sous-famille des halogénures d'acyle. Dérivé de l'acide acétique (acide éthanoïque), sa formule est CH3COCl.
| Chlorure d'acétyle | |||
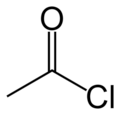 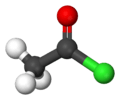 Représentations typologiques et « ball-and-stick (en) » du chlorure d'acétyle.  Chlorure d'acétyle liquide. |
|||
| Identification | |||
|---|---|---|---|
| Synonymes |
chlorure d'acétyle |
||
| No CAS | |||
| No ECHA | 100.000.787 | ||
| No EC | 200-865-6 | ||
| Apparence | liquide fumant incolore, d'odeur âcre[1]. | ||
| Propriétés chimiques | |||
| Formule brute | C2H3ClO [Isomères] |
||
| Masse molaire[2] | 78,498 ± 0,004 g/mol C 30,6 %, H 3,85 %, Cl 45,16 %, O 20,38 %, |
||
| Moment dipolaire | 2,72 ± 0,14 D [3] | ||
| Propriétés physiques | |||
| T° fusion | −112 °C[1] | ||
| T° ébullition | 51 °C[1] | ||
| Solubilité | dans l'eau : réaction[1] | ||
| Paramètre de solubilité δ | 19,4 MPa1/2 (25 °C)[4] | ||
| Masse volumique | 1,11 g·cm-3[1] | ||
| T° d'auto-inflammation | 390 °C[1] | ||
| Point d’éclair | 5 °C (coupelle fermée)[1] | ||
| Limites d’explosivité dans l’air | 7,3–19 %vol[1] | ||
| Pression de vapeur saturante | à 20 °C : 32 kPa[1] | ||
| Point critique | 58,7 bar, 234,85 °C [5] | ||
| Thermochimie | |||
| Cp | |||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 10,82 ± 0,04 eV (gaz)[7] | ||
| Précautions | |||
| SGH[8] | |||
  Danger |
|||
| SIMDUT[9] | |||
   B2, E, F, |
|||
| NFPA 704 | |||
| Transport | |||
| Composés apparentés | |||
| Autres composés |
chlorure de butyryle |
||
| Unités du SI et CNTP, sauf indication contraire. | |||
Propriétés
Le chlorure d'acétyle se présente sous la forme d'un liquide incolore, corrosif et volatil. Il n'existe pas dans la nature, parce qu'il réagit avec l'eau pour former de l'acide acétique et du chlorure d'hydrogène. Manipulé à l'air libre, cette réaction avec la vapeur d'eau ambiante provoque une fumée blanche toxique de chlorure d'hydrogène gazeux et de gouttelettes d'eau.
Synthèse
Le chlorure d'acétyle est synthétisé à partir d'acide acétique que l'on fait réagir avec du chlorure de thionyle :
- CH3COO-H + O=SCl2 → CH3COCl + SO2 + H-Cl.227277
Utilisation
On l'utilise comme réactif pour l'acétylation dans la synthèse ou la transformation de composés chimiques, par exemple pour l'estérification (exemple ci-dessous) et la réaction de Friedel-Crafts.
- CH3COCl + HO-CH2-CH3 → CH3-COO-CH2-CH3 + H-Cl
De telles acylations sont souvent effectuées en présence d'une base comme la pyridine, la triéthylamine ou le DMAP, qui en tant que catalyseur favorise la réaction et en tant que base neutralise l'acide chlorhydrique résultant.
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Acetyl chloride » (voir la liste des auteurs).
- CHLORURE D'ACETYLE, fiche(s) de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée(s) le 9 mai 2009
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 0387690026, lire en ligne), p. 294
- « Properties of Various Gases », sur flexwareinc.com (consulté le 12 avril 2010)
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-857-8)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 9781420066791), p. 10-205
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Chlorure d'acétyle » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
Lien externe
- Portail de la chimie
