Carboxysome
Un carboxysome est un microcompartiment bactérien contenant des enzymes impliquées dans la fixation du carbone[2]. Ces organites sont formés d'une coque protéique polyédrique d'environ 80 à 140 nm de diamètre. On les trouve chez toutes les cyanobactéries et de nombreuses bactéries chimiotrophes qui fixent le CO2[3]. On pense que ces compartiments permettent de concentrer le dioxyde de carbone autour de la Rubisco afin de favoriser l'activité carboxylase de cette enzyme limitante du cycle de Calvin, dont elle catalyse la première étape.
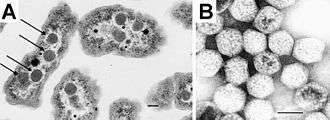
[B] Vue de carboxysomes intacts isolés d’H. neapolitanus ; la barre d'échelle indique une longueur de 100 nm[1].
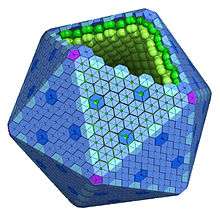
Les carboxysomes appartiennent à un groupe plus vaste de microcompartiments protéiques aux fonctions variées mais aux structures semblables reposant sur l'homologie de deux familles de protéines qui en constituent la coque[4].
Les carboxysomes adoptent une géométrie en icosaèdre ou quasiment icosaédrique, typiquement de 80 à 120 nm de diamètre[5]. Ils possèdent une coque externe constituée de quelques milliers de sous-unités protéiques qui encapsulent de multiples exemplaires des deux enzymes de fixation du carbone : l'anhydrase carbonique et la Rubisco.
La structure des protéines qui constituent la coque a été caractérisée par cristallographie aux rayons X[6]. La majorité d'entre elles forment un hexamère cyclique qui constitue le motif de base de la coque. Ces hexamères s'assemblent pour former des couches moléculaires denses qui constituent la coque externe. Des pores dans la structure pourraient permettre le passage des molécules de substrat — bicarbonate et ribulose-1,5-bisphosphate — et produit — 3-phosphoglycérate. Les résidus d'acides aminés chargés positivement présents dans les pores pourraient faciliter la diffusion de ces molécules de substrat et de produit, qui sont chargées négativement. Des protéines pentamériques pourraient quant à elles former les sommets de la coque icosaédrique[5].
Un certain nombre de capsides virales sont construites à partir de protéines hexamériques et pentamériques comme les carboxysomes, mais on ignore s'il existe une filiation entre les deux.
Les molécules d'enzymes semblent s'agencer en couches concentriques à l'intérieur de la coque protéique[7],[8]. Par ailleurs, la forme non icosaédrique de certains carboxysomes peut s'expliquer dans le cadre de la théorie élastique de coques minces hétérogènes[9].
Les travaux sur Halothiobacillus neapolitanus ont montré que des mutants dépourvus de Rubisco assemblent des coques vides de forme et de composition normales, ce qui suggère que la biogenèse des coques des carboxysomes et la séquestration de leur contenu enzymatique sont deux processus indépendants mais fonctionnellement liés. Il a également été montré que les carboxysomes de cette espèce s'accommodent de formes chimériques et hétérogènes de Rubisco et que c'est la grande sous-unité de la Rubisco qui détermine si l'enzyme est séquestrée dans des carboxysomes ou non[10].
Notes et références
- (en) Yingssu Tsai, Michael R Sawaya, Gordon C Cannon, Fei Cai, Eric B Williams, Sabine Heinhorst, Cheryl A Kerfeld et Todd O Yeates, « Structural Analysis of CsoS1A and the Protein Shell of the Halothiobacillus neapolitanus Carboxysome », PLoS Biology, vol. 5, no 6, , e144 (PMCID 1872035, lire en ligne) DOI:10.1371/journal.pbio.0050144
- (en) Murray R. Badger et G. Dean Price, « CO2 concentrating mechanisms in cyanobacteria: molecular components, their diversity and evolution », Journal of Experimental Botany, vol. 54, no 383, , p. 609-622 (lire en ligne) DOI:10.1093/jxb/erg076
- (en) Todd O. Yeates, Cheryl A. Kerfeld, Sabine Heinhorst, Gordon C. Cannon et Jessup M. Shively, « Protein-based organelles in bacteria: carboxysomes and related microcompartments », Nature Reviews Microbiology, vol. 6, , p. 681-691 (lire en ligne) DOI:10.1038/nrmicro1913
- (en) Gordon C. Cannon, Christopher E. Bradburne, Henry C. Aldrich, Stefanie H. Baker, Sabine Heinhorst et Jessup M. Shively, « Microcompartments in Prokaryotes: Carboxysomes and Related Polyhedra », Applied and Environmental Microbiology, vol. 67, no 12, , p. 5351-5361 (PMCID 93316, lire en ligne) DOI:10.1128/AEM.67.12.5351-5361.2001
- (en) Shiho Tanaka, Cheryl A. Kerfeld, Michael R. Sawaya, Fei Cai, Sabine Heinhorst, Gordon C. Cannon et Todd O. Yeates, « Atomic-Level Models of the Bacterial Carboxysome Shell », Science, vol. 319, no 5866, , p. 1083-1086 (lire en ligne) DOI:10.1126/science.1151458
- (en) Cheryl A. Kerfeld, Michael R. Sawaya, Shiho Tanaka, Chau V. Nguyen, Martin Phillips, Morgan Beeby et Todd O. Yeates, « Protein Structures Forming the Shell of Primitive Bacterial Organelles », Science, vol. 309, no 5736, , p. 936-938 (lire en ligne) DOI:10.1126/science.1113397
- (en) Michael F. Schmid, Angel M. Paredes, Htet A. Khant, Ferda Soyer, Henry C. Aldrich, Wah Chiu et Jessup M. Shively, « Structure of Halothiobacillus neapolitanus Carboxysomes by Cryo-electron Tomography », Journal of Molecular Biology, vol. 364, no 3, , p. 526-535 (PMCID 1839851, lire en ligne) DOI:10.1016/j.jmb.2006.09.024
- (en) Cristina V. Iancu, H. Jane Ding, Dylan M. Morris, D. Prabha Dias, Arlene D. Gonzales, Anthony Martino et Grant J. Jensen, « The Structure of Isolated Synechococcus Strain WH8102 Carboxysomes as Revealed by Electron Cryotomography », Journal of Molecular Biology, vol. 372, no 3, , p. 764-773 (PMCID 2453779, lire en ligne) DOI:10.1016/j.jmb.2007.06.059
- (en) Graziano Vernizzi, Rastko Sknepnek et Monica Olvera de la Cruz, « Platonic and Archimedean geometries in multicomponent elastic membranes », Proceedings of the National Academy of Sciences of the United States of America, vol. 108, no 11, , p. 4292-4296 (PMCID 3060260, lire en ligne) DOI:10.1073/pnas.1012872108
- (en) Balaraj B. Menon, Zhicheng Dou, Sabine Heinhorst, Jessup M. Shively et Gordon C. Cannon, « Halothiobacillus neapolitanus Carboxysomes Sequester Heterologous and Chimeric RubisCO Species », PLoS ONE, vol. 3, no 10, , e3570 (PMCID 2570492, lire en ligne) DOI:10.1371/journal.pone.0003570
- Portail de la biologie cellulaire et moléculaire