Bronopol
Le bronopol (2-bromo-2-nitropropane-1,3-diol) est un composé organique utilisé comme un antimicrobien. Il s'agit d'un solide blanc bien que les échantillons commerciaux apparaissent jaunes. Le bronopol a été inventé par The Boots Company PLC (en) au début des années 1960. En raison de sa faible toxicité pour les mammifères et une forte activité contre les bactéries, le bronopol est devenu populaire comme conservateur dans de nombreux produits de consommation tels que les shampooings et produits cosmétiques. Il a ensuite été adopté comme agent antimicrobien dans d'autres environnements industriels comme les usines de papier, l'exploration pétrolière et les installations de production, ainsi que de refroidissement des usines de désinfection de l'eau. Il est utilisé à des concentrations de 0,0025 % (25 parties par million).
| Bronopol | |||
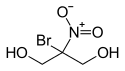 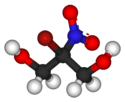 Structure du bronopol |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | 2-bromo-2-nitropropane-1,3-diol | ||
| Synonymes |
2-bromo-2-nitro-1,3-propanediol |
||
| No CAS | |||
| No ECHA | 100.000.131 | ||
| No EC | 200-143-0 | ||
| PubChem | 2450 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule brute | C3H6BrNO4 [Isomères] |
||
| Masse molaire[1] | 199,988 ± 0,005 g/mol C 18,02 %, H 3,02 %, Br 39,95 %, N 7 %, O 32 %, |
||
| Propriétés physiques | |||
| T° fusion | 130 à 133 °C[2] | ||
| Solubilité | 250 g·L-1 à 22 °C[2] | ||
| Point d’éclair | 167 °C[2] | ||
| Précautions | |||
| SGH[2] | |||
  Danger |
|||
| Transport[2] | |||
| Unités du SI et CNTP, sauf indication contraire. | |||
Production
Le bronopol est produit par la bromation du di (hydroxyméthyl) nitrométhane, qui est dérivé du nitrométhane.
Applications
Le bronopol est utilisé dans les produits de consommation comme un agent de conservation efficace, ainsi que dans une grande variété d'applications industrielles.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée de « Bronopol » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 23 avril 2013 (JavaScript nécessaire)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Bronopol » (voir la liste des auteurs).
- Portail de la chimie
