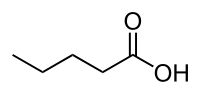
Acide pentanoïque
L'acide pentanoïque, ou acide méthyléthylacétique ou acide valérique, est un acide carboxylique linéaire de formule semi-développée CH3(CH2)3COOH. Il sert principalement à la synthèse d'arômes, d'adoucissants ou de produits agrochimiques. Il est également appelé acide valérique, car il a initialement été isolé des rhizomes de la valériane.
| Acide pentanoïque | |||||
 | |||||
| Identification | |||||
|---|---|---|---|---|---|
| Nom UICPA | acide pentanoïque | ||||
| Synonymes |
acide valérique |
||||
| No CAS | |||||
| No ECHA | 100.003.344 | ||||
| No EC | 203-677-2 | ||||
| PubChem | 7991 | ||||
| FEMA | 3101 | ||||
| SMILES | |||||
| InChI | |||||
| Propriétés chimiques | |||||
| Formule brute | C5H10O2 [Isomères] |
||||
| Masse molaire[1] | 102,1317 ± 0,0053 g/mol C 58,8 %, H 9,87 %, O 31,33 %, |
||||
| Propriétés physiques | |||||
| T° fusion | −32 °C [2] | ||||
| T° ébullition | 184 à 187 °C [2] | ||||
| Solubilité | 40 g·l-1 (eau,20 °C) [2] | ||||
| Paramètre de solubilité δ | 20,1 MPa1/2 (25 °C)[3]; 24,7 J1/2·cm-3/2 (25 °C)[4] |
||||
| Masse volumique | 0,9339 g·cm-3 à 25 °C[5] | ||||
| T° d'auto-inflammation | 375 °C [2] | ||||
| Point d’éclair | 87 °C [2] | ||||
| Limites d’explosivité dans l’air | 1,6–7,3 %vol [2] | ||||
| Précautions | |||||
| SGH[2] | |||||
 |
|||||
| SIMDUT[6] | |||||
   B3, D1B, E, |
|||||
| Transport[2] | |||||
| Écotoxicologie | |||||
| DL50 | 600 mg·kg-1 (souris, oral) 1,29 g·kg-1 (souris, i.v.) 3,59 g·kg-1 (souris, s.c.) 3,59 g·kg-1 (souris, i.p.) [7] |
||||
| LogP | 1,39 [2] | ||||
| Unités du SI et CNTP, sauf indication contraire. | |||||
Propriétés physico-chimiques
Il possède une odeur désagréable et caractéristique. Sa solubilité est limitée dans l'eau mais complète dans les solvants organiques communs[8].
Utilisation
Il est principalement utilisé en synthèse pour la production d'esters par réaction avec les alcools pour la fabrication d'arômes et d'adoucissants. Le sel de sodium et de calcium sont parfois utilisés comme fongicides[8].
Production et synthèse
L'acide pentanoïque est principalement produit par oxydation du pentanal en présence de dioxygène[8].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée de « Valeric acid » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 27 août 2010 (JavaScript nécessaire)
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 0387690026, lire en ligne), p. 294
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- (en) Wai-Ting Vong et Fuan-Nan Tsai, « Densities, Molar Volumes, Thermal Expansion Coefficients, and Isothermal Compressibilities of Organic Acids from 293.15 K to 323.15 K and at Pressures up to 25 MPa », J. Chem. Eng. Data, vol. 42, no 6, , p. 1116-1120 (DOI 10.1021/je970005k)
- « Acide valérique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 27 août 2010
- (en) « Pentanoic acid » sur ChemIDplus, consulté le 27 août 2010
- (en) Wilhelm Riemenschneider, Carboxylic Acids, Aliphatic, Wiley-VCH Verlag GmbH & Co, coll. « Ullmann's Encyclopedia of Industrial Chemistry », (DOI 10.1002/14356007.a05_235, présentation en ligne)
Voir aussi
- Liste d'acides
- Pentanoate
- Portail de la chimie