Stérilisation animale
La stérilisation animale est le retrait des organes reproductifs d'un animal, soit dans leur totalité, soit d'une partie importante.
Méthodes de stérilisation animale
Femelle (spaying)

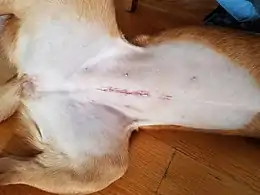
Chez les animaux femelles, le spaying implique une chirurgie abdominale pour retirer les ovaires et l’utérus. Parmi les autres possibilités figurent :
- ne retirer que les ovaires, ce qui se fait principalement chez les chattes et les jeunes chiennes ;
- ou d'utiliser la méthode, peu courante, de « Ovary Sparing Spay » (« castration épargnant l'ovaire ») dans laquelle l'utérus est retiré mais où un voire deux des ovaires sont laissés.
Le spaying traditionnel se fait sur les animaux domestiques tels que les chats et les chiens pour contrôler les naissances. Il est plus rare sur le bétail. Chez les juments, les raisons justifiant la castration incluent notamment la modification du comportement.
Méthodes chirurgicales
La chirurgie peut se faire en utilisant l'approche traditionnelle, c'est-à-dire en pratiquant une ouverture, ou par chirurgie cœlioscopique. La première est plus facilement disponible du fait du surcoût des équipements chirurgicaux nécessaires à la chirurgie cœlioscopique.
Chirurgie traditionnelle
La chirurgie ouverte traditionnelle est généralement effectuée par une incision ventrale centrale sous le nombril. La taille de l'incision varie en fonction du chirurgien et de la taille de l'animal. Les cornes utérines sont identifiées et les ovaires sont trouvées en remontant les cornes.
Un ligament attache les ovaires au corps, celui-ci est parfois sectionné afin d'identifié les ovaires. Les artères alimentant les ovaires sont ensuite ligaturées avec le matériel de suture nécessaire puis sont ensuite sectionnées. L'utérus et les artères qui y sont liées sont ensuite resserré au niveau du cervix (laissant le cervix comme barrière naturelle). L'utérus entier et les ovaires sont ensuite retirés. L'abdomen est vérifié pour voir s'il n'y a pas de saignement, puis refermé en trois couches. Le tissu conjonctif et les couches sous cutanées sont ensuite refermées avec le matériel de suture nécessaire, enfin la peau est agrafée, suturé ou collée ensemble.
Chirurgie cœlioscopique
La chirurgie cœlioscopique est faite en utilisant une caméra et des instruments placés à travers des petites incisions dans le corps. Le patient est anesthésié et allongé sur le dos. Les incisions ne mesurent que 5 à 10 millimètres et leur nombre varie en fonction de l'équipement et de la technique utilisée. Le chirurgien regarde un écran lors de l'opération. La première incision se fait derrière le nombril et une caméra est insérée. L'abdomen est gonflé avec du dioxyde de carbone pour créer la place permettant l'opération. Une deuxième incision est ensuite effectuée, quelques centimètres à l'avant du nombril et un instrument permettant de saisir est introduit, le forceps Babcock. Le chirurgien cherche alors l'ovaire et utilise ensuite l'instrument pour le suspendre sur une aiguille passée à travers le mur abdominal. Cela soulève de manière sûre l'ovaire et l'utérus des autres organes. Le chirurgien retire ensuite le forceps et insère un instrument servant à cautériser et couper le tissu. Cet instrument utilise l'électricité pour chauffer les vaisseaux sanguins, les sceller et les couper. Aucune suture n'a lieu en interne. L'ovaire est séparé de l'utérus et du ligament. L'instrument de cautérisation est retiré par le forceps qui retire l'ovaire par le trou fait dans la paroi abdominale. Cela est répété de l'autre côté avec l'autre ovaire puis les trous dans la peau sont fermés avec des points de suture.
Le bénéfice de cette chirurgie est une douleur de moindre ampleur, un rétablissement plus rapide et de plus petites cicatrice.
Conséquences
Le spaying sur des chiennes empêche la production de progestérone, une hormone décontractante naturelle. Le spaying peut donc accentuer les comportements agressifs observables vis-à-vis des humains où des autres chiens.
Le risque d'infection, de saignement, de rupture, d'inflammation et de réaction aux médicaments donné à un animal durant la procédure sont des possibilités à considérer.
Mâle (castration ou vasectomie)
Chez les mâles, la castration implique le retrait des testicules, et se fait de manière commune à la fois sur les animaux domestiques (pour contrôler les naissances ou modifier les comportements) et sur le cheptel (pour contrôler les naissances mais également pour améliorer la valeur commerciale).
Injections
- Animaux mâles : injection d'une solution de dihydrate de chloride de calcium dans les testicules de l'animal cause une castration non chirurgicale. Au bout d'un mois, la nécrose des tissus testiculaire entraîne la castration[1],[2].
- Chiens : le Neutersol. Cytotoxicité : cause une infertilité irréversible en perturbant la chimie des testicules[3].
- Rats mâles – Adjudin entraîne une castration réversible.
- Souris mâles : injection d'une solution de molécule JQ1[4].
- Moutons et cochons mâles – micro-valve sans fil[5]. Utilisant un polymer piézoélectrique qui se déformera quand il sera exposé à une émission électrique d'une clef, une valve s'ouvrira et se fermera empêchant le passage du sperme mais pas du liquide séminal.
- Mammifère femelle : vaccin d’antigène (dérivée de Porcine zona pellucida purifiée) encapsulé dans du liposome avec un adjuvant.
Conséquences sur la santé et le comportement
Sources
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Neutering » (voir la liste des auteurs).
- R. Leoci, G. Aiudi, F. Silvestre et G. M. Lacalandra, « Chemical sterilization with calcium chloride: a dose dependent study in the dog" and "Dog chemical castration by intratesticular injection of a calcium chloride in an alcohol solution », 1st International Conference on Dog Population Management,
- L. M. Koger, « Calcium Chloride, Practical Necrotizing Agent », Journal of the American Association of Bovine Practitioners (U.S.), vol. 12, , p. 118–119
- « Neutersol and Esterilsol » [archive du ], sur acc-d.org, Alliance for Contraception in Cats and Dogs (consulté le )
- Martin M. Matzuk, Michael R. McKeown, Panagis Filippakopoulos, Qinglei Li, Lang Ma, Julio E. Agno, Madeleine E. Lemieux, Sarah Picaud, Richard N. Yu, Jun Qi, Stefan Knapp et James E. Bradner, « Small-Molecule Inhibition of BRDT for Male Contraception », Cell, vol. 150, no 4, , p. 673–684 (PMID 22901802, PMCID 3420011, DOI 10.1016/j.cell.2012.06.045, lire en ligne)
- Inke Jones, Lucas Ricciardi, Leonard Hall, Hedley Hansen, Vijay Varadan, Chris Bertram, Simon Maddocks, Stefan Enderling, David Saint, Said Al-Sarawi et Derek Abbott, « Wireless RF communication in biomedical applications », IOP Publishing Ltd, vol. 17, , p. 8–9 (DOI 10.1088/0964-1726/17/1/015050, lire en ligne [PDF], consulté le )
- Lee B. Smith, L. Milne, N. Nelson, S. Eddie, P. Brown, N. Atanassova, M. K. O’Bryan, L. O’Donnell, D. Rhodes, S. Wells, D. Napper, P. Nolan, Z. Lalanne, M. Cheeseman et J. Peters, « KATNAL1 Regulation of Sertoli Cell Microtubule Dynamics is Essential for Spermiogenesis and Male Fertility », PLOS Genetics, vol. 8, , e1002697 (PMID 22654668, PMCID 3359976, DOI 10.1371/journal.pgen.1002697, lire en ligne)
- Jeffrey T. Jensen, Mary B. Zelinski, Jessica E. Stanley, John W. Fanton et Richard L. Stouffer, « The phosphodiesterase 3 inhibitor ORG 9935 inhibits oocyte maturation in the naturally selected dominant follicle in Rhesus macaques », Contraception, vol. 77, no 4, , p. 303–7 (PMID 18342656, PMCID 2505347, DOI 10.1016/j.contraception.2008.01.003)
- Portail de la médecine
- Portail de la zoologie
- Portail de l’élevage