Romiplostim
Le romiplostim est une protéine de fusion analogue à la thrombopoïétine (TPO), une hormone qui stimule la formation de plaquettes sanguines et la prolifération de leurs précurseurs (les mégacaryocytes).
| romiplostim | |
| Classe | Médicaments du sang et des organes hématopoïétiques, antihémorragiques, autres hémostatiques systémiques, ATC code B02BX04 |
|---|---|
| Identification | |
| No CAS | |
| Code ATC | B02BX04 |
| DrugBank | 05332 |
Structure
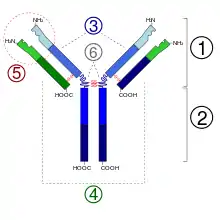
1. Fragment Fab
2. Fragment Fc
3. Chaîne lourde (en bleu) avec une région variable (VH) suivie d'une région constante (CH1), une région charnière, et deux autres régions constantes (CH2 and CH3).
4. Chaîne légère (en vert) avec une région variable (VL) et une constante (CL)
5. Paratope
6. Régions charnières.
Le romiplostim est composé :
- d'un fragment Fc d'un anticorps IgG1 permettant d’accroître la demi-vie plasmatique de la molécule ;
- d'une chaine peptidique sans homologie de séquence avec la TPO mais qui se fixe sur le récepteur de la TPO (Tpo-R). Cette partie assure l'activité biologique de la protéine de fusion.
Chaque sous-unité du domaine Fc de l'immunoglobuline est liée au niveau C-terminal de façon covalente à cette chaîne peptidique contenant deux domaines de liaison au récepteur à la TPO (Tpo-R)[1]. L'ensemble est appelé un peptibody ou pepticorps[Note 1].
Recherche et développement
Le romiplostim a été développé par l'entreprise américaine Amgen et mis sur le marché sous le nom commercial de Nplate[2]. Pendant sa période d'essai la molécule portait le nom de code AMG531[3].
La Food and Drug Administration a donné son autorisation de mise sur le marché (AMM) du romiplostim (Nplate) pour le traitement des thombocytopénies chez les patients présentant un purpura thrombopénique idiopathique (PTI) le [4].
Le produit a obtenu une AMM européenne centralisée le avec un Plan de Gestion des Risques (PGR) européen[5].
Indications
En France, le romiplostim est indiqué dans le traitement du purpura thrombopénique idiopathique (PTI) chronique de l’adulte en échec aux traitements habituels (corticoïdes, immunoglobulines) chez les patients réfractaires à la splénectomie et chez les patients non splénectomisés mais auxquels la splénectomie ne peut être proposée[6].
Effets secondaires
- Thrombocytose.
- Augmentation de la réticuline dans la moelle osseuse.
- Complications thrombotiques, thromboemboliques.
- Risque d’immunogénicité (développement d’anticorps neutralisants interagissant avec la thrombopoïétine endogène).
- Risque de fibrose de la moelle osseuse.
- Risque d’hyperleucocytose et d’anémie.
- Risque d’insuffisance rénale[5].
Les données disponibles d’une étude clinique randomisée réalisée chez des patients atteints de thrombopénie associée à un syndrome myélodysplasique (SMD), montrent une augmentation du nombre de cas de progression de la maladie en leucémie aiguë myéloïde (LAM) et des augmentations transitoires du nombre de cellules blastiques chez les patients traités par romiplostim par rapport au placebo[7].
Notes et références
Notes
- Par analogie avec l'anglais : antibody ou anticorps.
Références
- (en) David J. Kuter, in Hematopoietic Growth Factors in Oncology, Springer US, (ISBN 978-1-4419-7072-5, lire en ligne), « Romiplostim », pp 267-288.
- Fiche Vidal.
- (en) (en) M.S.H. Lam, « Review Article: Second-generation thrombopoietin agents for treatment of chronic idiopathic thrombocytopenic purpura in adults », Journal of oncology pharmacy practice, vol. 16, no 2, , p. 89-103 (PMID 19525300, DOI 10.1177/1078155209337668, lire en ligne, consulté le ).
- (en) « FDA Approves Nplate(TM) for Long-Term Treatment of Adult Chronic ITP », Amgen, .
- Médicaments faisant l’objet d’un Plan de Gestion des Risques (PGR), Agence nationale de sécurité du médicament et des produits de santé (ANSM), 18 juin 2013.
- Synthèses d'avis et fiches bon usage, Haute Autorité de santé (HAS), 10 juin 2009.
- Lettre aux professionnels de santé ANSM, 26 septembre 2011.