Représentation de Cram
La représentation de Cram ou projection de Natta d'une molécule permet sa représentation dans l'espace : elle fait apparaître les liaisons en perspective. Elle s'emploie à chaque fois que la stéréochimie des composés organiques ou inorganiques (comme les complexes) doit être précisée. C'est le cas des composés chiraux qui possèdent des carbones asymétriques, des jonctions de cycles, des isomères cis / trans par rapport à des cycles, etc.
Une des premières utilisations de cette notation remonte à Richard Kuhn qui, en 1932, a utilisé des lignes épaisses et des pointillés dans une publication. Les coins solides et hachurés modernes ont été introduits dans les années 1940 par Giulio Natta pour représenter la structure des hauts polymères, et largement popularisés dans le manuel de chimie organique de 1959 de Donald J. Cram et George S. Hammond[11].
Notations de la convention de Cram ou de Natta
Cette méthode de représentation se base sur quelques règles simples :
- Une liaison, entre deux atomes dans le plan de la feuille, est représentée par un trait simple :
- Une liaison, entre un atome dans le plan et un atome en avant de la feuille, est représentée par un trait gras ou un triangle plein, la pointe étant du côté de l'atome dans le plan, la base du côté de l'autre atome :
- Une liaison, entre un atome dans le plan et un atome en arrière du plan, est représentée par un trait en pointillé ou un triangle hachuré dont la pointe est du côté de l'atome dans le plan, la base du côté de l'autre atome :
- On choisit comme plan de la feuille celui de la molécule qui contient le plus de liaisons, ainsi la molécule de méthane est représentée avec l'atome de C et deux atomes d'H dans le plan de la feuille, et non vue d'une direction transverse, qui donnerait deux triangles et deux traits en pointillé ; de même la molécule d'ammoniac doit être représentée avec deux liaisons N-H dans le plan et la dernière soit vers l'avant, soit vers l'arrière, et non avec l'atome d'azote seul dans le plan de la feuille, et comme on le voit parfois trois angles entre triangles de 120°, ce qui permet de plus d'indiquer l'angle précis entre deux liaisons.
Exemples
Cette représentation s'utilise soit pour représenter la géométrie complète d'une molécule possédant peu d'atomes, soit pour indiquer la stéréochimie d'un centre stéréogène (en anglais stereocenter) dont la stéréochimie doit attirer l'attention du lecteur.
Cas d'une molécule possédant peu d'atomes
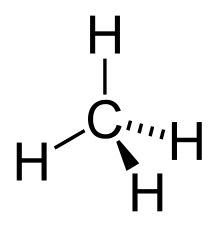
Afin de représenter la géométrique tétraédrique du méthane, la représentation de Cram s'utilise de la façon ci-contre.
- Le H du dessus et celui de gauche sont dans le plan de la représentation.
- Celui qui est au bout d'un triangle plein est en avant.
- Celui qui est au bout d'un pointillé est en arrière
Cas d'un centre stéréogène
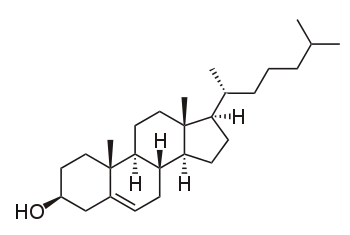
Cette représentation indique la stérochimie de certains centres asymétriques de la molécule de cholestérol :
- Le OH est au-dessus du plan.
- Les deux triangles noirs pour lesquels aucun symbole n'est indiqué représentent des groupements CH3 qui se trouvent en avant du plan. Ils contribuent à indiquer la stéroéchimie de la jonction des cycles.
- Les triangles pointillés qui se prolongent par le symbole H indiquent la présence d'un atome en arrière du plan de représentation. Ils contribuent aussi à préciser la stéréochimie de jonction des cycles.
L'absence d'information sur le reste de la molécule n'indique pas qu'elle se situe dans un plan. Par exemple le cycle de gauche possède une forme chaise qui n'est pas précisée. Soit parce que c'est considéré comme évident par l'auteur de la représentation, soit parce que son évocation n'a pas d'intérêt pour le propos sur lequel il communique.
Cas d'un complexe
2NO-2D.png.webp)
La géométrie des liaisons autour du cobalt, dans le complexe octaédrique ci-contre, est indiqué par les conventions de Cram.
Autres conventions de représentations
La représentation de Cram est lourde à utiliser pour les structures possédant un grand nombre de centres dont la stéréochimie doit être précisée, comme le glucose par exemple. D'autres convention peuvent être alors utilisées :
- Projection de Fischer (surtout pour les sucres dans leur structure linéaire)
- Projection de Haworth (surtout pour les sucres dans leur structure cyclique)
- Projection de Newman (surtout pour représenter le résultat de la rotation autour d'une liaison sigma)
Structures
Dans le cadre de la théorie VSEPR, on désigne la géométrie de l'atome par AXnEm où n représente le nombre de substituants et m le nombre de doublets non liants. Pour un atome tétravalent (comme le carbone ou la silicium), 6 géométries sont alors possibles :
- AX4E0: 4 voisins, l'atome sera au centre d'un tétraèdre.
- AX3E1: 3 voisins et 1 doublet non liant, l'atome sera au sommet d'une pyramide.
- AX3E0: 3 voisins et aucun doublet non liant, l'atome sera au centre d'un triangle dont les angles font tous 120° et la représentation sera plane.
- AX2E2: 2 voisins et 2 doublets non liants, l'atome sera au milieu d'une coudée et la représentation sera plane.
- AX2E1: 2 voisins et 1 doublet non liant, l'atome sera au centre d'un triangle, et ses 2 voisins seront chacun situés à l'un des sommets et la représentation sera plane.
- AX2E0: 2 voisins, l'atome aura ses 2 voisins de chaque côté, ces derniers étant opposés et à 180° de l'autre et la représentation sera plane.
Pour tous les atomes, il est possible, à partir du nombre de doublets non liants et d'atomes liés, de connaître la géométrie autour de l'atome considéré (ci-après, on désigne un doublet non liant ou une liaison simple avec un atome par le terme général de doublet, et on ne tient pas compte des liaisons pi) :
- 2 doublets : géométrie linéaire plane ; les deux doublets sont alignés.
- 3 doublets : géométrie triangulaire plane ; les doublets forment des angles de 120°.
- 4 doublets : géométrie tétraédrique ; les doublets forment des angles de 109,5°.
- 5 doublets : géométrie bipyramidale à base triangulaire. 3 atomes forment la base de la pyramide (angle de 120° entre eux) et 2 atomes forment les sommets des deux pyramides (angles de 90° avec les atomes de la base). En présence de doublets non liants, ceux-ci occupent la base de la pyramide (pour maximiser les angles des atomes avec le doublet non liant).
- 6 doublets : géométrie octaédrique (bipyramide à base carrée) ; les doublets forment des angles de 90°.
- Portail de la chimie