Peroxyde de sodium
Le peroxyde de sodium, ou commercialement appelé oxylithe[3], est un produit chimique de formule brute Na2O2.
| Peroxyde de sodium | |||
| |||
 | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | Peroxyde de sodium | ||
| No CAS | |||
| No ECHA | 100.013.828 | ||
| No CE | 215-209-4 | ||
| SMILES | |||
| InChI | |||
| Apparence | poudre blanche à jaune | ||
| Propriétés chimiques | |||
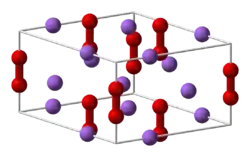
| Formule | Na2O2 [Isomères] |
||
| Masse molaire[1] | 77,9783 ± 0,0006 g/mol Na 58,96 %, O 41,04 %, |
||
| Propriétés physiques | |||
| T° fusion | 675 °C | ||
| Masse volumique | 2,8 g·cm-3 | ||
| Point d’éclair | non inflammable | ||
| Thermochimie | |||
| S0solide | 95 J K-1 mol-1 | ||
| ΔfH0solide | -513 kJ mol-1 | ||
| Précautions | |||
| SGH[2] | |||
  Danger |
|||
| NFPA 704 | |||
| Transport | |||
| Unités du SI et CNTP, sauf indication contraire. | |||
Il est mis au point au début du XXe siècle par le chimiste George-François Jaubert pour produire de l'oxygène[4],[5]. C'est un composé chimique solide friable de couleur bleutée, qui se dissout au contact de l'eau en libérant de l'oxygène[6],[7]. La réaction, très violente, est fortement exothermique. Du fait de cette réactivité, l'oxylithe doit être absolument conservée à l'abri de l'humidité. Stockée sans précautions particulière, elle finit par se désagréger au contact de la vapeur d'eau présente dans l'air ambiant. Ce produit ne doit pas non plus entrer au contact de la peau (en particulier, on ne doit le manipuler qu'avec une pince), car ses effets déshydratants provoquent des brûlures sérieuses.
L'oxylithe a été utilisé dans les premiers masques à gaz[8], qui équipaient les mines de charbon puis plus tard l'infanterie française pendant la Première Guerre mondiale. Il était encore utilisé dans les cours de chimie de l'enseignement secondaire dans les années 1980.
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- G.-F. Jaubert, « Le quotient respiratoire et la régénération de l'air en circuit fermé par les peroxydes », Gaz de combat, défense passive, 1re année no 1,
- M. Chaussart, « Pierre d'oxygène », Gazette des hôpitaux de Toulouse, , p. 2 (lire en ligne)
- anon., « Le boroxylithe », Journal de Monaco, no 2426, , p. 190
- L. Guillet, L'industrie de la soude, Gauthier Villars, Masson et Cie, , « X. L'industrie du sodium et du peroxyde de sodium », p. 133
- Anon., « Science notes », Scientific American, , p. 190 (lire en ligne)
- G.-F. Jaubert, « Sur les appareils respiratoires à peroxydes alcalins », Comptes rendus hebdomadaires des séances de l’Académie des sciences, vol. 197, , p. 484
- Portail de la chimie

