Organoïde
En culture cellulaire, un organoïde est une structure multicellulaire tridimensionnelle qui reproduit in vitro la micro-anatomie d'un organe ; c'est donc un modèle de l'organe (ou un mini-organe). Un organoïde est généralement obtenu à partir d'une ou plusieurs cellules précurseurs d'un tissu, de cellules souches embryonnaires ou de cellules souches pluripotentes induites, qui peuvent s'auto-organiser en trois dimensions, notamment grâce à leurs propriétés d'auto-renouvellement et de différenciation.
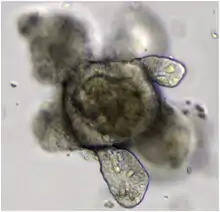
Les techniques d'obtention et de production d'organoïdes de différents tissus se sont développées de manière accélérée depuis les années 2010. Ces méthodes ont été considérées comme l'une des plus grandes avancées scientifiques de l'année 2013 par la revue The Scientist[1].
Histoire
La génération d'organoïdes a connu un bond en avant avec l'utilisation de système de culture tridimensionnel de cellules souches à la place des traditionnelles techniques en couche. En 2008, Yoshiki Sasai et son équipe de l´institut RIKEN ont démontré que les cellules souches peuvent être agrégées en cellules neurales qui s'auto-organisent en différentes couches[2]. En 2009, le laboratoire de Hans Clevers, de l'Hubrecht Institut aux Pays-bas, a montré qu'une seule cellule souche intestinale LGR5-positive isolée pouvait reformer en culture une structure et une diversité cellulaire similaires aux cryptes et villosités de l'épithélium intestinal[3]. Ces principes ont depuis été adaptés à de nombreux organes.
Types d'organoïdes
- Organoïde cérébral
- Organoïde de thyroïde[4]
- Organoïde thymique [5]
- Organoïde intestinal[3]
- Organoïde testiculaire
- Organoïde hépatique[6]
- Organoïde pancréatique[7]
- Organoïde gastrique[8]
- Organoïde épithélial[3],[9]
- Organoïde pulmonaire[10]
- Organoïde rénal[11],[12],[13],[14]
- Organoïde d´embryon précoce (Gastruloïde)[15],[16]
Utilisation en recherche fondamentale
Avantages : Plus simples qu'un organe entier, mais plus représentatifs que des grappes de cellules mises en culture, les organoïdes sont d'excellents outils pour l'étude des processus biologiques fondamentaux. Ils permettent d'étudier comment les cellules interagissent dans un organe, de comprendre leurs interactions avec leur environnement, comment les maladies affectent cet organe et l'effet de certains médicaments. La culture in vitro rend le système facile à manipuler et facilite les observations. Tandis que les organes sont difficiles à cultiver en raison de leur grande taille qui limite la pénétration des éléments nutritifs, la petite taille des organoïdes réduit ce problème. Une limitation est qu'ils ne récapitulent pas toutes les fonctions de l'organe et que les interactions avec d'autres organes ne sont pas simulées in vitro. Bien que la recherche sur les cellules souches et leurs propriétés ont été le premier champ d'application des organoïdes[3]; ils sont aussi utilisés pour étudier les fonctions des organes. Les embryons de mammifères sont souvent bien protégés et donc particulièrement difficiles à étudier in vivo. Les organoïdes permettent partiellement de contourner cet obstacle et ils offrent une fenêtre sur l'évolution, dans la mesure ou l'embryogenèse est supposée refléter certaines étapes de l'évolution[17].
Formés de types cellulaires spécifiques s'auto-organisant et récapitulant divers aspects de l'organogenèse, ce sont de véritables modèles 3D très utiles pour l'étude du début du développement des organes, de même que pour étudier certaines interactions tissulaires[18]. Si construits à partir de cellules provenant d'un patient, ils peuvent éclairer les effets de certaines anomalies génétiques ou ce qui se produit dans certains états pathologiques (cancer notamment)[18] ; les organoïdes ont permis de produire de nouveaux modèles de cancer humain (organoïdes en expansion indéfinie, produits à partir d'un extrait de tissu tumoral d'individus souffrant de carcinomes, ainsi qu'une variante génique, construite par CRISPR, via l'introduction d'altérations génétiques induisant le cancer dans des organoïdes normaux[19]. Quand on les associe à des cellules immunitaires et à des fibroblastes, les organoïdes tumoraux deviennent des modèles pour le microenvironnement du cancer, permettant des applications en immuno-oncologie[19].
Des médicaments peuvent aussi être directement testés sur des organoïdes afin de mieux prédire leurs effets positifs (et éventuellement négatifs) y compris dans le contexte de futurs traitements personnalisés[19].
Limites : En 2019, les organoïdes sont encore relativement simples et ne font qu'approcher la réalité, notamment car ils sont observés hors des éléments physicochimiques et écologiques de l'environnement qui dans la réalité influencent aussi fortement la dynamique cellulaire et la morphogenèse. En outre, chez les organismes complexes, plusieurs lignées cellulaires sont souvent nécessaire pour construire un même organe[18].
Pour des modèles plus fidèles à la réalité, on cherche à lister, comprendre et reconstruire des interactions proches de ce qu'elles seraient dans le véritable organe, via des co-cultures avec d'autres cellules. Il s'agit par exemple de pouvoir aboutir à un tissu multicouche et fonctionnel, et de fonctions d'ordre supérieur[20] ; un système vasculaire fonctionnel ou assurer l'innervation. Il s'agit aussi de pouvoir simuler un écoulement de fluide (notamment dans les "organoïdes sur puce"[18] (utilisable comme micro-plate-forme, pour la biomédecine notamment)[21]. On espère pouvoir ainsi mieux comprendre les processus de l'embryologie et en particulier la synthèse des trois couches germinales, la rupture de symétrie et la formation des axes. Il deviendrait alors peut-être possible de développer une ingénierie spécifique, pour par exemple pouvoir régénérer certains organes malades ou blessés, et supprimer les rejets de greffe en utilisant des organes issus d'organoïdes[18].
Une nouvelle génération d'organoïdes est attendue, où les biologistes pourraient maitriser la configuration, l'assemblage, la morphogenèse, la croissance et la fonction de tissus et organes de plus en plus complexes[20].
Modèle de maladie
Les organoïdes permettent de créer des modèles cellulaires de maladies humaines, qui peuvent être étudiés au laboratoire afin de mieux comprendre les causes de la maladie et d'identifier des traitements possibles. Par exemple, la modification du génome au moyen du système CRISPR peut être appliquée à des cellules souches pluripotentes humaines pour introduire des mutations ciblées dans des gènes pertinents, comme illustré pour deux maladies du rein, la maladie polycystique du rein et la glomérulosclérose segmentaire et focale[13].
Organoïdes et médecine personnalisée
Différents individus peuvent répondre de manière différente aux traitements médicamenteux. On peut générer des organoïdes à partir de tissus de patients portant des mutations particulières ou bien à partir de tumeurs et tester in vitro l´efficacité d'un traitement. Ceci est illustré pour la mucoviscidose. Des organoïdes intestinaux produits à partir de biopsies rectales peuvent être produits pour tester l´effet des traitements disponibles[22].
Notes et références
- Kerry Grens, « 2013’s Big Advances in Science », The Scientist, (consulté le )
- Ed Yong, « Lab-Grown Model Brains », The Scientist, (consulté le )
- Toshiro Sato, Robert G. Vries, Hugo J. Snippert et Marc Van De Wetering, « Single Lgr5 stem cells build cryptvillus structures in vitro without a mesenchymal niche », Nature, vol. 459, no 7244, , p. 262–5 (PMID 19329995, DOI 10.1038/nature07935, Bibcode 2009Natur.459..262S)
- Andreas Martin, Giuseppe Barbesino et Terry F. Davies, « T-Cell Receptors and Autoimmune Thyroid Disease—Signposts for T-Cell-Antigen Driven Diseases », International Reviews of Immunology, vol. 18, nos 1–2, , p. 111–40 (PMID 10614741, DOI 10.3109/08830189909043021)
- Nicholas Bredenkamp, Svetlana Ulyanchenko, Kathy Emma O’Neill et Nancy Ruth Manley, « An organized and functional thymus generated from FOXN1-reprogrammed fibroblasts », Nature Cell Biology, vol. 16, no 9, , p. 902–908 (PMID 25150981, PMCID 4153409, DOI 10.1038/ncb3023, lire en ligne)
- Huch, H Gehart, R Van Boxtel et K Hamer, « Long-Term Culture of Genome-Stable Bipotent Stem Cells from Adult Human Liver », Cell, vol. 160, nos 1–2, , p. 299–312 (PMID 25533785, PMCID 4313365, DOI 10.1016/j.cell.2014.11.050)
- Huch, P Bonfanti, S. F. Boj et T Sato, « Unlimited in vitro expansion of adult bi-potent pancreas progenitors through the Lgr5/R-spondin axis », The EMBO Journal, vol. 32, no 20, , p. 2708–2721 (PMID 24045232, PMCID 3801438, DOI 10.1038/emboj.2013.204)
- Stange, B. K. Koo, M Huch et G Sibbel, « Differentiated Troy+ chief cells act as 'reserve' stem cells to generate all lineages of the stomach epithelium », Cell, vol. 155, no 2, , p. 357–368 (PMID 24120136, PMCID 4094146, DOI 10.1016/j.cell.2013.09.008)
- Nick Barker, Johan H. Van Es, Jeroen Kuipers et Pekka Kujala, « Identification of stem cells in small intestine and colon by marker gene Lgr5 », Nature, vol. 449, no 7165, , p. 1003–7 (PMID 17934449, DOI 10.1038/nature06196, Bibcode 2007Natur.449.1003B)
- Joo-Hyeon Lee, Dong Ha Bhang, Alexander Beede et Tian Lian Huang, « Lung Stem Cell Differentiation in Mice Directed by Endothelial Cells via a BMP4-NFATc1-Thrombospondin-1 Axis », Cell, vol. 156, no 3, , p. 440–455 (ISSN 0092-8674, PMID 24485453, PMCID 3951122, DOI 10.1016/j.cell.2013.12.039, lire en ligne)
- M. Unbekandt et J.A. Davies, « Dissociation of embryonic kidneys followed by reaggregation allows the formation of renal tissues. », Kidney International, vol. 77, no 5, , p. 407–416 (DOI 10.1038/ki.2009.482, lire en ligne)
- Minoru Takasato, Pei X. Er, Han S. Chiu et Barbara Maier, « Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis », Nature, vol. 526, no 7574, , p. 564–568 (DOI 10.1038/nature15695, lire en ligne)
- BS Freedman, CR Brooks, AQ Lam et H Fu, « Modelling kidney disease with CRISPR-mutant kidney organoids derived from human pluripotent epiblast spheroids », Nature Communications, vol. 6, , p. 8715 (PMID 26493500, DOI 10.1038/ncomms9715)
- Ryuji Morizane, Albert Lam, Benjamin Freedman et Seiji Kishi, « Nephron organoids derived from human pluripotent stem cells model kidney development and injury », Nature Biotechnology, vol. 33, no 11, , p. 1193–1200 (DOI 10.1038/nbt.3392, lire en ligne)
- Susanne C. van den Brink, Peter Baillie-Johnson, Tina Balayo et Anna-Katerina Hadjantonakis, « Symmetry breaking, germ layer specification and axial organisation in aggregates of mouse embryonic stem cells », Development (Cambridge, England), vol. 141, no 22, , p. 4231–4242 (ISSN 1477-9129, PMID 25371360, PMCID 4302915, DOI 10.1242/dev.113001)
- David A. Turner, Peter Baillie-Johnson et Alfonso Martinez Arias, « Organoids and the genetically encoded self-assembly of embryonic stem cells », BioEssays: News and Reviews in Molecular, Cellular and Developmental Biology, vol. 38, no 2, , p. 181–191 (ISSN 1521-1878, PMID 26666846, PMCID 4737349, DOI 10.1002/bies.201500111)
- Marta N. Shahbazi1, Eric D. Siggia & Sagdalena Zernicka-Goetz (2019) Self-organization of stem cells into embryos: A window on early mammalian development|Science 07 Jun 2019:Vol. 364, Issue 6444, pp. 948-951 |DOI: 10.1126/science.aax0164
- Beverly A. Purnell & Marc Lavine (2019), Approximating organs ; Science 07 Jun 2019:Vol. 364, Issue 6444, pp. 946-947 | DOI: 10.1126/science.aay1351
- David Tuveson & Hans Clevers (2019) Cancer modeling meets human organoid technology| Science 07 Jun 2019:Vol. 364, Issue 6444, pp. 952-955 DOI: 10.1126/science.aaw6985
- Takanori Takebe & James M. Wells (2019) Organoids by design | Science 07 Jun 2019 : Vol. 364, Issue 6444, pp. 956-959 | DOI: 10.1126/science.aaw7567
- Sunghee Estelle Park, Andrei Georgescu & Dongeun Huh (2019) Organoids-on-a-chip |Science 07 Jun 2019: Vol. 364, Issue 6444, pp. 960-965 |DOI: 10.1126/science.aaw7894
- JF Dekkers, G Berkers, E Kruisselbrink et A Vonk, « Characterizing responses to CFTR-modulating drugs using rectal organoids derived from subjects with cystic fibrosis », Science Translational Medicine, vol. 8, , p. 344ra84 (PMID 27334259, DOI 10.1126/scitranslmed.aad8278)
Voir aussi
Bibliographie
Liens externes
- «Organoïdes : small is beautiful» La Méthode scientifique, France Culture, .
- [vidéo] Comment faire pousser des organes ? sur YouTube, chaine Scilabus.
- Portail de la biologie cellulaire et moléculaire