Loi des états correspondants
En physique, la loi des états correspondants (ou principe des états correspondants), formulée par Johannes Diderik van der Waals, énonce que tous les corps purs à l'état fluide, aux mêmes température réduite (température thermodynamique divisée par la température critique du corps) et pression réduite (pression divisée par la pression critique du corps), présentent assez exactement le même facteur de compressibilité, et que tous s'écartent du modèle du gaz parfait au même degré[1],[2].
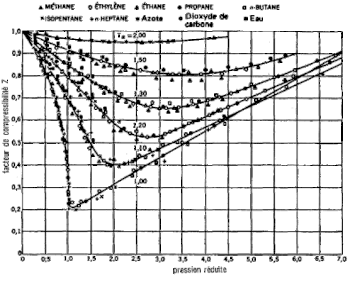
Historique
La figure ci-dessus montre que les isothermes de diverses espèces tracées dans un diagramme d'Amagat (facteur de compressibilité en fonction de la pression réduite) sont presque identiques, d'où l'idée de van der Waals[3] d'une équation d'état universelle et la loi des états correspondants : pour les mêmes coordonnées réduites (pression, température et volume rapportés respectivement à la pression critique, la température critique et le volume critique de l'espèce chimique), toutes les espèces ont le même facteur de compressibilité. Les constantes matérielles qui dépendent de la nature du gaz sont ainsi éliminées pour former une équation d'état réduite, adimensionnelle.
L'équation d'état résultant de ces travaux est l’équation d'état de van der Waals (1873) qui valut le prix Nobel de physique à son inventeur en 1910.
Compressibilité au point critique
Le facteur de compressibilité au point critique, défini par , où l'indice fait référence au point critique, doit être une constante indépendante des substances ou de leur équation d'état ; l’équation de Van der Waals, par ex., prédit une valeur de . Le tableau suivant montre que le facteur de compressibilité critique n'est pas une constante universelle : la loi des états correspondants n'est pas exacte.
| Substance | |
|---|---|
| H2O | 0,23[4] |
| 4He | 0,31[4] |
| He | 0,30[5] |
| H2 | 0,30[5] |
| Ne | 0,29[5] |
| N2 | 0,29[5] |
| Ar | 0,29[5] |
Notes et références
- Cf. Jefferson W. Tester et Michael Modell, Thermodynamics and its applications, Prentice Hall, , 936 p. (ISBN 0-13-915356-X).
- Y. A. Çengel et M. A. Boles, Thermodynamics : An Engineering Approach, McGraw Hill, (réimpr. 6e), 976 p. (ISBN 978-0-07-125771-8, lire en ligne), p. 141.
- Cf. by Walter M. Kalback et Kenneth E. Starling, « A Four-Parameter Corresponding States Correlation for Fluid Compressibility Factors », Proc. Okla. Acad. Sci., no 56, , p. 125-132 (lire en ligne).
- (en) David Goodstein, States of Matter, Toronto, Canada, General Publishing Company, Ltd., (réimpr. 1re), 500 p. (ISBN 0-486-64927-X, lire en ligne), « 6 - Critical Phenomena and Phase Transitions », p. 452.
- J. de Boer, « Quantum theory of condensed permanent gases : I the law of corresponding states », Physica, Utrecht, Elsevier, vol. 14, , p. 139–148 (DOI 10.1016/0031-8914(48)90032-9, Bibcode 1948Phy....14..139D).
Voir aussi
Bibliographie
- Aide-mémoire de Thermodynamique, Francis Meunier, p. 74, éd. Dunod, 2014 (ISBN 978-2-10-071534-3).
Articles connexes
Liens externes
- « Théorie des États correspondants », sur SklogWiki.
- Jacques Schwarzentruber (EMAC), « Les états correspondants », ENS des mines d'Albi-Carmaux.
- Portail de la physique
- Portail des sciences des matériaux