Cellule souche embryonnaire
Une cellule souche embryonnaire (CSE) est une cellule souche pluripotente issue de la masse cellulaire interne d’un embryon préimplantatoire au stade de blastocyste[1],[2]. Un embryon humain atteint le stade de blastocyste 4 à 5 jours après la fécondation et consiste en un amas de 50 à 150 cellules (masse cellulaire interne et trophectoderme). L'isolation de la masse cellulaire interne requiert de détruire le blastocyste.
Les cellules souches embryonnaires sont une source quasi-parfaite pour les greffes et l'ingénierie tissulaire. La capacité d'une cellule souche à générer l'ensemble des cellules du corps en fait un outil clé pour la recherche sur les maladies humaines, notamment génétique, ou pour tester in vitro la toxicologie de médicaments.
Cependant, l'isolation de cellules souches embryonnaires pose un questionnement éthique qui nécessite notamment d'établir si un embryon au stade préimplantatoire possède les mêmes droits légaux et moraux qu'un être humain plus développé[3],[4]. A l'inverse, ne pas utiliser ces cellules capables de sauver des vies est-il juste, alors que les embryons préimplantatoires surnuméraires ne seront pas utilisé et donc détruits ? Il n'existe pas de consensus et la législation sur l'obtention et l'utilisation en recherche de ces cellules souches embryonnaires varie selon les pays.
Une des alternatives aux cellules souches embryonnaires est d'utiliser des cellules souches pluripotentes induites qui sont générées à partir de cellules différenciées (par exemple, des cellules de peau) et ne présentent donc pas ce même dilemme éthique.
Historique
Les cellules souches embryonnaires ont été identifiées en 1981 chez la souris par Martin Evans, Kaufman et Martin[5],[6], et en 1998 chez l’homme par les équipes de James Alexander Thomson, de Joseph Istkovitz-Eldor et de Benjamin Reubinoff[7],[8].
Biologie
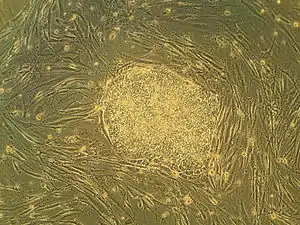
Les cellules souches embryonnaires (CSE) isolées in vitro dans la masse cellulaire interne du blastocyste (embryon au 5 ou 6e jour chez l’homme).
La masse cellulaire interne a la propriété de donner naissance in vivo aux trois feuillets embryonnaires (endoderme, mésoderme et ectoderme) à l'origine de tous les tissus d’un être humain adulte.
Cette propriété de pluripotence in vivo est très rapidement perdue au cours du développement embryonnaire.
En 1981 on a réussi chez la souris à conserver in vitro à l’état de pluripotence des cellules de la masse cellulaire d’un blastocyste et à les faire proliférer indéfiniment : c’était la naissance des cellules souches embryonnaires. Ces lignées cellulaires sont génétiquement normales, à la différence des lignées de tumeurs malignes. À tout moment, y compris après plusieurs années de culture, il reste possible de faire différencier ces cellules en n’importe quel type cellulaire. Si des cellules souches embryonnaires de souris – y compris si elles ont été génétiquement modifiées - sont injectées dans un blastocyste de souris, elles contribuent à tous les tissus du souriceau, y compris la lignée germinale. Cette approche a permis la création des animaux KO et transgéniques et ces travaux ont été couronnés par le prix Nobel de médecine en 2007.
En 1998, ces résultats ont été reproduits chez l’homme par la dérivation des premières lignées de cellules souches embryonnaires humaines. La propriété de pluripotence est attestée in vivo par la formation de tératomes comportant des tissus différenciés issus des trois feuillets embryonnaires, après injection à la souris SCID. In vitro, l'utilisation de conditions de culture spécifiques entraîne la différenciation des cellules souches embryonnaires humaines vers des types cellulaires matures tels que neurones, cardiomyocytes, hépatocytes, cellules hématopoïétiques etc.
En 2009/2010, on a montré - chez des souriceaux - que des neurones issus de CSE greffées dans le cortex visuel se connectaient aux autres neurones en évitant les régions du cerveau dont elles ne sont pas spécifiques sans, par exemple, se connecter aux neurones de la moelle épinière. Alors que des CSE greffées dans la moelle s'y sont installées sans se connecter au cortex visuel ni à d'autres organes[9]. Si ceci se vérifie aussi chez la souris adulte, une nouvelle piste de régénération physique de lésions nerveuses cérébrales serait ouverte.
Juridique
La loi n° 2004-800 du 6 août 2004 relative à la bioéthique modifiant celle de 1994, permet par dérogation pour une période de cinq ans de conduire une recherche sur l'embryon humain : « les recherches peuvent être autorisées sur l'embryon et les cellules embryonnaires lorsqu'elles sont susceptibles de permettre des progrès thérapeutiques majeurs et à condition de ne pouvoir être poursuivies par une méthode alternative d'efficacité comparable, en l'état des connaissances scientifiques ». Ces recherches sont encadrées par l'Agence de la Biomédecine.
Par ailleurs, le , la Cour de justice de l'Union européenne a écarté, au nom de l'art. 6 de la Directive sur la brevetabilité des inventions biotechnologiques, un brevet portant sur des cellules obtenues à partir de cellules souches embryonnaires humaines.
Notes et références
- Thomson, J Itskovitz-Eldor, SS Shapiro, MA Waknitz, JJ Swiergiel, VS Marshall et JM Jones, « Blastocysts Embryonic Stem Cell Lines Derived from Human », Science, vol. 282, no 5391, , p. 1145–1147 (PMID 9804556, DOI 10.1126/science.282.5391.1145)
- « NIH Stem Cell Basics. What are embryonic stem cells? »
- Baldwing A, « Morality and human embryo research. Introduction to the Talking Point on morality and human embryo research. », EMBO Reports, vol. 10, no 4, , p. 299–300 (PMID 19337297, PMCID 2672902, DOI 10.1038/embor.2009.37)
- Andrea C. Nakaya, Biomedical ethics, San Diego, CA, ReferencePoint Press, , 96 p. (ISBN 978-1-60152-157-6 et 1-60152-157-X)
- (en) Nature, 1981, Vol. 292:154-6, Evans and Kaufman, Establishment in culture of pluripotential cells from mouse embryos
- (en) Proc Natl Acad Sci U S A. 1981, 78:7634-8., Martin GR, Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells
- (en) Thomson JA et al. Science 1998, 282:1145-7 Embryonic stem cell lines derived from human blastocysts.
- (en) Nat Biotechnol. 2000, 18:399-404, Reubinoff BE et al. Embryonic stem cell lines from human blastocysts: somatic differentiation in vitro.
- Makoto Ideguchi, Theo D. Palmer, Lawrence D. Recht, and James M. Weimann ; Murine Embryonic Stem Cell-Derived Pyramidal Neurons Integrate into the Cerebral Cortex and Appropriately Project Axons to Subcortical Targets ; The Journal of Neuroscience, 20 janvier 2010, 30(3):894-904; doi:10.1523/JNEUROSCI.4318-09.2010 (Résumé)
- Portail de la biologie cellulaire et moléculaire