Calcul des titres et des volumes d'alcools
Le calcul des titres et des volumes d'alcools est utilisé en distillation car on ne peut pas prévoir avec précision le résultat (titre alcoolique et volume) d'un mélange de deux liquides hydro-alcooliques. La différence de force des liaisons intermoléculaires (liaisons hydrogène) entre les molécules d'eau et les molécules d'alcool (éthanol) entraîne des variations de volume massique en fonction du titre alcoolique qui doivent être prises en compte. La table des densités, utile aussi pour les pesées d'alcool, permet de calculer ces variations de volume massique.
Alcoométrie volumique
| % | +0,5 | +1 | +2 | +3 | +4 | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| 0 | 99820 | 99744 | 99670 | 99596 | 99523 | 99451 | 99381 | 99311 | 99241 | 99173 |
| 5 | 99106 | 99039 | 98973 | 98908 | 98843 | 98779 | 98716 | 98654 | 98592 | 98531 |
| 10 | 98471 | 98411 | 98352 | 98294 | 98235 | 98178 | 98121 | 98064 | 98008 | 97952 |
| 15 | 97897 | 97842 | 97787 | 97733 | 97679 | 97625 | 97571 | 97517 | 97463 | 97409 |
| 20 | 97356 | 97302 | 97248 | 97194 | 97140 | 97086 | 97031 | 96976 | 96921 | 96866 |
| 25 | 96810 | 96753 | 96697 | 96639 | 96581 | 96523 | 96464 | 96404 | 96344 | 96283 |
| 30 | 96221 | 96159 | 96095 | 96031 | 95966 | 95901 | 95834 | 95766 | 95698 | 95629 |
| 35 | 95559 | 95488 | 95415 | 95342 | 95269 | 95194 | 95118 | 95041 | 94963 | 94884 |
| 40 | 94805 | 94724 | 94642 | 94559 | 94476 | 94391 | 94306 | 94219 | 94132 | 94043 |
| 45 | 93954 | 93864 | 93773 | 93681 | 93588 | 93495 | 93400 | 93305 | 93209 | 93112 |
| 50 | 93014 | 92916 | 92816 | 92716 | 92616 | 92514 | 92412 | 92309 | 92206 | 92101 |
| 55 | 91996 | 91891 | 91784 | 91677 | 91570 | 91462 | 91353 | 91243 | 91133 | 91023 |
| 60 | 90911 | 90800 | 90687 | 90574 | 90460 | 90346 | 90231 | 90115 | 89999 | 89882 |
| 65 | 89765 | 89647 | 89528 | 89409 | 89289 | 89169 | 89048 | 88926 | 88803 | 88680 |
| 70 | 88556 | 88432 | 88306 | 88181 | 88054 | 87927 | 87799 | 87670 | 87540 | 87410 |
| 75 | 87279 | 87148 | 87015 | 86882 | 86748 | 86613 | 86478 | 86341 | 86204 | 86066 |
| 80 | 85927 | 85787 | 85646 | 85505 | 85362 | 85219 | 85074 | 84929 | 84782 | 84634 |
| 85 | 84485 | 84335 | 84184 | 84031 | 83877 | 83721 | 83564 | 83405 | 83245 | 83082 |
| 90 | 82918 | 82752 | 82583 | 82413 | 82239 | 82063 | 81885 | 81703 | 81518 | 81330 |
| 95 | 81138 | 80942 | 80742 | 80537 | 80327 | 80112 | 79890 | 79662 | 79425 | 79180 |
| 100 | 78924 | |||||||||
On appelle alcool une solution hydro-alcoolique dont le titre en éthanol varie de 0 à 100 %. On nomme Ρ sa masse volumique et T son titre en pourcentage volumique à 20 °C (noté °). À 20 °C la masse volumique de l'air vaut 1,20 g/l à la pression normale.
Masse volumique à 20 °C de l'alcool à 66,80° = 89409 -- 3/5 (89409-89289) = 89337 cg/l.
Le mélange d'un volume V1 d'alcool de titre T1 et d'un volume V2 d'alcool de titre T2 donne, après refroidissement et dissipation des bulles d'air, un alcool de titre T de volume V inférieur à V1+V2. On dit qu'un alcool a été réduit ou l'autre remonté. Les volumes étant à la température du titre (20 °C), la définition des titres et des masses volumiques conduit à deux égalités qui expriment la conservation du volume d'alcool pur extractible et la conservation de la masse :
Calcul de deux volumes
Si l'on exprime V2 avec la première égalité et avec la seconde on obtient une équation sans V2 d'où l'on tire V1 ,et ensuite V2 en permutant les indices :
On peut aussi exprimer V1 en fonction de V2 et V en fonction de V1 ou de V2 .Toute recherche de deux volumes d'un mélange dont les trois titres sont connus trouve ici sa solution. Les calculs sont simplifiés en cas de dilution dans l'eau puisque T2 est nul.
Exemple : pour remonter à 55° 1 litre d'alcool à 20° avec de l'alcool à 90° on va exprimer V1[note 1] et V en fonction de V2 :
et
On obtient également V en reportant 0,9450 dans l'expression de TV ou de PV.
Si l'on opère à 15 °C, le litre d'alcool à 20° devient 0,998 litre[note 2] ; il faut le mélanger à 0,940 litre[note 3] d'alcool à 90° pour obtenir 1,902 litre[note 4] d'alcool à 55°.
Le coefficient de dilatation cubique du verre Pyrex est 0,00001/°C mais celui du polyméthylpentène est trente-quatre fois plus grand ; à 15 °C il faut mesurer 0,94 x 1,0017 = 0,942 litre d'alcool 1 dans un récipient en P.M.P gradué pour 20 °C.
La contraction rapportée à V est et rapportée à V1+V2 ; c'est-à-dire, à 20 °C,
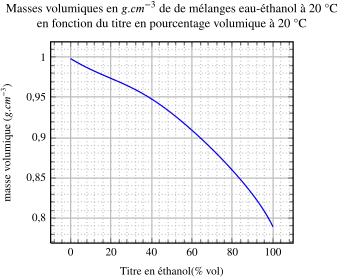
La très petite “contraction” d'un mélange d'alcools faibles peut être négative : le changement de courbure du graphe de Ρ de T explique cela. S'il n'y avait ni retrait ni expansion la courbe serait droite.
Calcul d'un volume et d'un titre
Si on cherche un volume et un titre il faut appliquer une méthode itérative ; c'est-à-dire évaluer le volume au moyen de l'approximation V = V1+V2 ,puis le titre approché avec l'expression de TV et, avec la table, la masse volumique. En déduire une meilleure évaluation du volume avec l'expression de PV et continuer jusqu'à obtenir deux valeurs du titre égales à l'incertitude près (au mieux 0,05° si les composants du mélange sont titrés à l'alcoomètre).
Exemple : à 20 °C, que faut il verser dans une bonbonne de dix litres à moitié pleine d'alcool à 70° pour la remplir d'alcool à 45° ?
V2 = 5 . . . . . T2 = 20 . .. . P2 = 97356 ←- (ne serait-ce pas le titre d'un alcool à 20% au lieu de celui de 70% (88556)) ?
V2 = 5,1025 . T2 = 19,60 . P2 = 97399
V2 = 5,1003 . T2 = 19,61 . P2 = 0,97398 kg/l et on retient 5,100 litres à 19,6°.
Si l'on préfère peser l'alcool 2 de masse P2V2 = 4,968 kg, la masse lue en kilogramme entre 9 et 31 °C est, sous pression normale,
Elle vaut 4,962 kg si on compte 7 kg/l pour les poids.
À 20 °C on peut aussi mélanger les cinq litres à 70° avec cinq litres à 20° et attendre le refroidissement à 20 °C pour ajuster en une ou deux fois le volume avec de l'eau.
Notes et références
- OIML, Tables alcoométriques internationales : Recommandation R22-fr, (lire en ligne)
- Notes
- L'indice 1 signale l'alcool le plus fort
- 0,998 est égal à masse volumique à 20 °C / masse volumique à 15 °C = 97356 / 97524
- 0,940 est égal à 0,945 x 82918 / 83350
- 1,902 est égal à 1,91 x 91996 / 92384
Articles connexes
- Portail de la chimie
- Alimentation et gastronomie