Hydrogénosulfate de potassium
L'hydrogénosulfate de potassium ou bisulfate de potassium est un sel de formule chimique KHSO4.
| Hydrogénosulfate de potassium | |
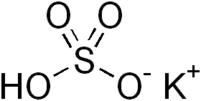
| |
| Identification | |
|---|---|
| Nom UICPA | hydrogénosulfate de potassium |
| Synonymes |
bisulfate de potassium |
| No CAS | |
| No ECHA | 100.028.722 |
| No CE | 231-594-1 |
| No RTECS | TS7200000 |
| PubChem | 516920 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | KHSO4 |
| Masse molaire[1] | 136,169 ± 0,006 g/mol H 0,74 %, K 28,71 %, O 47 %, S 23,55 %, |
| Propriétés physiques | |
| Solubilité | 490 g·l-1 (eau, 20 °C)[2] |
| Masse volumique | 2,24 g·cm-3 (solide, 20 °C)[2] |
| Précautions | |
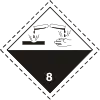
| SIMDUT[3] | |
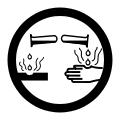 E, |
|
| NFPA 704[4] | |
| Directive 67/548/EEC[5] | |
 C |
|
| Transport[2] | |
| Écotoxicologie | |
| DL50 | 2,34 g·kg-1 (rat, oral)[6] |
| Unités du SI et CNTP, sauf indication contraire. | |
Production et synthèse
Une voie de synthèse est le procédé Berlin où l'acide sulfurique réagit avec du chlorure de potassium pour donner un mélange d'hydrogénosulfate de potassium et de pyrosulfate de potassium, K2S2O7. De l'acide chlorhydrique relativement pur est produit comme coproduit[7].
Le sel et l'acide sont mélangés dans un four et chauffé jusqu'à 300 °C pour former une pâte. Le chlorure d'hydrogène est récupéré par évaporation, puis absorbé dans de l'eau[7].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Potassium hydrogensulfate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 29 mars 2010 (JavaScript nécessaire)
- « Numéro 52506 » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 29 mars 2010
- UCB Université du Colorado
- « Hydrogénosulfate de potassium », sur ESIS, consulté le 29 mars 2010
- (en) « Hydrogénosulfate de potassium », sur ChemIDplus, consulté le 29 mars 2010
- (en) Severin Austin et Arndt Glowacki, Hydrochloric Acid, Wiley-VCH Verlag GmbH & Co, coll. « Ullmann's Encyclopedia of Industrial Chemistry », (DOI 10.1002/14356007.a13_283, présentation en ligne)
- Portail de la chimie
Cet article est issu de Wikipedia. Le texte est sous licence Creative Commons - Attribution - Partage dans les Mêmes. Des conditions supplémentaires peuvent s'appliquer aux fichiers multimédias.