Acide sulfonique
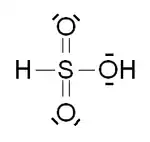
Les acides sulfoniques sont une classe de composés organosulfurés de formule générale formula R−S(=O)2−OH, où R est un groupe alkyle ou aryle et S(=O)2(OH) est l'hydroxyde de sulfonyle[1]. En tant que substituant, ce groupe est appelé groupe sulfo. Les acides sulfoniques peuvent être considérés comme des dérivés de l'acide sulfurique, dont l'un des groupes hydroxyle serait remplacé par un substituant organique. Le composé parent, avec tous les substituants remplacés par de l'hydrogène, et qui donne son nom à la famille est l'acide sulfonique, HS(=O)2(OH), un composé hypothétique, tautomère instable de l'acide sulfureux HO-SO-OH. En effet, ni l'acide sulfonique ni l'acide sulfureux n'ont jamais été isolés ou observés, mais le mono-anion de ces espèces hypothétiques existe en solution, en équilibre entre ses formes tautomères.

Les sels et esters des acides sulfoniques sont appelés sulfonates.
Utilisation des acides sulfoniques
L'acide sulfonique le plus simple est l'acide méthanesulfonique CH3SO2OH, qui est un réactif très utilisé en synthèse organique. Parmi les autres acides sulfoniques courants, on peut citer également l'acide paratoluènesulfonique, souvent appelé par son sigle, « APTS ».
Les propriétés chimiques des acides sulfoniques sont similaires à celles des acides carboxyliques et des carboxylates correspondants, mais ils sont généralement plus forts que les acides carboxyliques correspondants.
- Ils ont la propriété originale de se lier par des liaisons de faible énergie (liaisons hydrogène) aux protéines ou aux glucides. Pour cette raison, la plupart des teintures lavables sont des acides sulfoniques (ou contiennent un groupement fonctionnel sulfonyle -SO2-). C'est aussi pourquoi ils sont utilisés dans la chromatographie liquide haute performance (HPLC) afin de séparer les acides aminés d'un échantillon[2].
- Ils sont également utilisés comme catalyseurs ou intermédiaires réactionnels dans la fabrication d'un grand nombre de composés organiques.
- Leurs sels (sulfonates) sont très utilisés comme détergents.
- Ils entrent dans la composition de biocides (antibactériens...).
Production
Il a par exemple en France été produit près de Lille à partir de 1925, dans une partie du site chimique situé à l'Ouest de Lille à La Madeleine, Saint-André, Marquette[3] qui fut rachetée par Rhône-Poulenc Chimie, et ensuite devenu possession de Rhodia ; avec une capacité de 100 tonnes par semaine. Il était alors obtenu par mélange gravitaire, dans le secteur dit Secteur ANS du site Rhodia opération SAS (Nord) (aujourd'hui fermé)
Il est aussi fabriqué naturellement en petite quantité, vite dissous par les larmes, quand de l'oxyde de propanethial (C3H6OS), dégagé par les oignons, rencontre les muqueuses oculaires[3].
Notes et références
- March, Jerry, Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, New York, Wiley, (ISBN 0-471-60180-2)
- programme de biochimie en première année commune aux études de santé.
- BASOL (Base de données sur les sites et sols pollués (ou potentiellement pollués) appelant une action des pouvoirs publics, à titre préventif ou curatif ) ; DRIRE Nord/Pas-de-Calais (devenue DREAL), Fiche Usine Rhodia-Intermédiaire (Site sur La Madeleine, Saint-André et Marquette) , dont le dernier exploitant est la « société Rhodia Intermédiaires (ex-Rhône Poulenc Chimie) », Fiche mise à jour 2009-11-23 et consulté 2011-11-29
Voir aussi
Articles connexes
- Sulfonyle
- Sulfonate
- Halogénure d'acide sulfonique
- Sulfonium
- Ester sulfonique
- Biocide
- Dispersant (dont contre les marées noires)
- Portail de la chimie